9-Hydroperoxy-10,12-octadecadiensäure
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
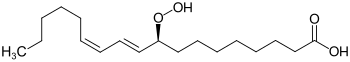
| |||||||||||||
| (S)-Enantiomer | |||||||||||||
| Allgemeines | |||||||||||||
| Name | 9-Hydroperoxy-10,12-octadecadiensäure | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C18H32O4 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 312,44 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
9-Hydroperoxy-10E,12Z-octadecadiensäure ist eine konjugierte Fettsäure mit einer Hydroperoxid-Funktion und kommt natürlich als biosynthetisches Intermediat vor, das aus Linolsäure gebildet und weiter zu Oxylipinen umgesetzt wird. Ein ebenfalls vorkommendes Isomer ist die 13-Hydroperoxy-9,11-octadecadiensäure. Auch Linolensäure bildet analoge Hydroperoxide.[2]
Vorkommen und Bedeutung
[Bearbeiten | Quelltext bearbeiten]9-Hydroperoxy-10-12-octadecadiensäure ist ein Intermediat bei verschiedenen biosynthetischen Prozessen in Pflanzen, insbesondere der Bildung von Oxylipinen.[3] Die Verbindung ist chiral und kommt natürlich vor allem als (S)-Enantiomer vor.[4] Beispielsweise bildet die Lipoxygenase aus Kartoffeln bevorzugt enenatiomerenreine (S)-9-Hydroperoxy-10-12-octadecadiensäure.[5] Die Lipoxygenase aus Tomaten bildet zu etwa 99 % das (S)-9-Hydroperoxid mit einem Enantiomerenüberschuss von etwa 82 %.[6] Demgegenüber bildet die Lipoxygenase aus Sojabohnen bevorzugt 13-Hydroperoxy-9,11-octadecadiensäure und in geringeren Mengen das 9-Isomer und dieses auch nicht enantiomerenrein, sondern zu etwa 73 % (S)-Konfiguration und zu 27 % (R)-Konfiguration.[5] Oxylipine, die aus der Verbindung gebildet werden, sind unter anderem Hydroxy-Verbindungen, Epoxyhydroxy-Verbindungen, Aldehyde, Ketone und Divinylether.[3][2]
Ein wichtiger Prozess, der über 9-Hydroperoxy-10-12-octadecadiensäure als Intermediat verläuft, ist die Biosynthese der Colnelsäure durch eine Divinylether-Synthase (z. B. in Tabak, Kartoffeln oder Tomaten).[3][4][7][8][9] Eine Hydroperoxid-Lyase kann die Verbindung in Aldehyde, (3Z)-Nonenal und 9-Oxononansäure, spalten. Dieser Reaktionsweg ist zum Beispiel in der Familie Cucurbitaceae verbreitet und die gebildeten Verbindungen sind wichtige Aromastoffe in Gurken und Melonen (Cucumis melo).[10][11][12] Auch 4-Hydroxy-2-nonenal wird in Pflanzen aus 9-Hydroperoxy-10,12-octadecadiensäure gebildet, wobei fast racemisches Produkt entsteht.[13]
Bei Grünen Pfirsichblattläusen auf Ackerbohnen wurde nachgewiesen, dass diese Oxylipine von den Pflanzen aufnehmen, darunter auch 9-Hydroperoxy-10-12-octadecadiensäure.[14]
-
Tabakpflanze
-
Kartoffelpflanze
-
Gurkenpflanze
-
Melonenpflanze
-
Grüne Pfirsichblattläuse
Biosynthese
[Bearbeiten | Quelltext bearbeiten]Die Verbindung wird durch eine Lipoxygenase aus Linolsäure gebildet. Die Reaktion läuft über einen antarafacialen Angriff eines enzymgebundenen Disauerstoffmoleküls und führt durch die Stereoselektivität zum (9S)-Isomer.[4][15] Linolsäure kann auch 13-Hydroperoxy-9,11-octadecadiensäure bilden. Manche pflanzlichen Enzyme bilden selektiv vorwiegend nur eines der beiden Positionsisomere, andere bilden beide.[4][2][7][15] Enzyme, die vor allem das 9-Isomer bilden, kommen zum Beispiel in Kartoffeln und Tomaten vor, solche, die beide Isomere bilden, z. B. in Stachelbeeren, Hefe und anderen Pilzen.[15][16]
Synthese
[Bearbeiten | Quelltext bearbeiten]Die Synthese aus Linolsäure mittels eines geeigneten Enzyms (z. B. aus Mais) ist auch im Labor möglich.[7] Die Regioselektivität hängt dabei stark vom pH ab. Bei pH 6,6 wird vor allem das 9-Isomer gebildet, bei pH 9 vor allem das 13-Isomer.[17]
Nachweis
[Bearbeiten | Quelltext bearbeiten]Zum Nachweis werden Hydroperoxide wie 9-Hydroperoxy-10-12-octadecadiensäure vorzugsweise in stabilere Verbindungen überführt. Diese Verbindung kann konkret in Methyl-9-Hydroxystearat und dann deren Trimethylsilylether überführt werden und dieser durch GC-MS nachgewiesen werden.[18]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c T. V. Savchenko, O. M. Zastrijnaja, V. V. Klimov: Oxylipins and plant abiotic stress resistance. In: Biochemistry (Moscow). Band 79, Nr. 4, April 2014, S. 362–375, doi:10.1134/S0006297914040051.
- ↑ a b c Tatyana Savchenko, Evgeny Degtyaryov, Yaroslav Radzyukevich, Vlada Buryak: Therapeutic Potential of Plant Oxylipins. In: International Journal of Molecular Sciences. Band 23, Nr. 23, 23. November 2022, S. 14627, doi:10.3390/ijms232314627, PMID 36498955, PMC 9741157 (freier Volltext).
- ↑ a b c d Ren Wang, Wenbiao Shen, Linglong Liu, Ling Jiang, Yuqiang Liu, Ning Su, Jianmin Wan: A novel lipoxygenase gene from developing rice seeds confers dual position specificity and responds to wounding and insect attack. In: Plant Molecular Biology. Band 66, Nr. 4, März 2008, S. 401–414, doi:10.1007/s11103-007-9278-0.
- ↑ a b Vladimir Nikolaev, Pallu Reddanna, Jay Whelan, George Hildenbrandt, C.Channa Reddy: Stereochemical nature of the products of linoleic acid oxidation catalyzed by lipoxygenases from potato and soybean. In: Biochemical and Biophysical Research Communications. Band 170, Nr. 2, Juli 1990, S. 491–496, doi:10.1016/0006-291X(90)92118-J.
- ↑ Catherine N.S.P. Suurmeijer, Manuela Pérez-Gilabert, Harry T.W.M. van der Hijden, Gerrit A. Veldink, Johannes F.G. Vliegenthart: Purification, product characterization and kinetic properties of soluble tomato lipoxygenase. In: Plant Physiology and Biochemistry. Band 36, Nr. 9, September 1998, S. 657–663, doi:10.1016/S0981-9428(98)80014-4.
- ↑ a b c Vladimir Y Gorshkov, Yana Y Toporkova, Ivan D Tsers, Elena O Smirnova, Anna V Ogorodnikova, Natalia E Gogoleva, Olga I Parfirova, Olga E Petrova, Yuri V Gogolev: Differential modulation of the lipoxygenase cascade during typical and latent Pectobacterium atrosepticum infections. In: Annals of Botany. Band 129, Nr. 3, 11. Februar 2022, S. 271–286, doi:10.1093/aob/mcab108, PMID 34417794, PMC 8835645 (freier Volltext).
- ↑ E. J. Corey, Stephen W. Wright: Total synthesis of colneleic acid. In: The Journal of Organic Chemistry. Band 55, Nr. 5, März 1990, S. 1670–1673, doi:10.1021/jo00292a049.
- ↑ Payal Sanadhya, Anil Kumar, Patricia Bucki, Nathalia Fitoussi, Mira Carmeli-Weissberg, Menachem Borenstein, Sigal Brown-Miyara: Tomato Divinyl Ether-Biosynthesis Pathway Is Implicated in Modulating of Root-Knot Nematode Meloidogyne javanica's Parasitic Ability. In: Frontiers in Plant Science. Band 12, 25. August 2021, doi:10.3389/fpls.2021.670772, PMID 34512679, PMC 8424051 (freier Volltext).
- ↑ K Matsui, A Minami, E Hornung, H Shibata, K Kishimoto, V Ahnert, H Kindl, T Kajiwara, I Feussner: Biosynthesis of fatty acid derived aldehydes is induced upon mechanical wounding and its products show fungicidal activities in cucumber. In: Phytochemistry. Band 67, Nr. 7, April 2006, S. 649–657, doi:10.1016/j.phytochem.2006.01.006.
- ↑ Kenji Matsui, Chika Ujita, Sho-hei Fujimoto, Jack Wilkinson, Bill Hiatt, Vic Knauf, Tadahiko Kajiwara, Ivo Feussner: Fatty acid 9- and 13-hydroperoxide lyases from cucumber 1. In: FEBS Letters. Band 481, Nr. 2, 15. September 2000, S. 183–188, doi:10.1016/S0014-5793(00)01997-9.
- ↑ Nathalie Tijet, Claus Schneider, Bernard L. Muller, Alan R. Brash: Biogenesis of Volatile Aldehydes from Fatty Acid Hydroperoxides: Molecular Cloning of a Hydroperoxide Lyase (CYP74C) with Specificity for both the 9- and 13-Hydroperoxides of Linoleic and Linolenic Acids. In: Archives of Biochemistry and Biophysics. Band 386, Nr. 2, Februar 2001, S. 281–289, doi:10.1006/abbi.2000.2218.
- ↑ Claus Schneider, Keri A. Tallman, Ned A. Porter, Alan R. Brash: Two Distinct Pathways of Formation of 4-Hydroxynonenal. In: Journal of Biological Chemistry. Band 276, Nr. 24, Juni 2001, S. 20831–20838, doi:10.1074/jbc.M101821200.
- ↑ Nicolas Harmel, Pierre Delaplace, Elizabeth Blée, Patrick Du Jardin, Marie-Laure Fauconnier: Myzus persicae Sulzer aphid contains oxylipins that originate from phloem sap. In: Journal of Plant Interactions. Band 2, Nr. 1, März 2007, S. 31–40, doi:10.1080/17429140701320880.
- ↑ a b c Leslie Crombie, David O. Morgan, Elisabeth H. Smith: An isotopic study (2H and 18O) of the enzymic conversion of linoleic acid into colneleic acid with carbon chain fracture: the origin of shorter chain aldehydes. In: Journal of the Chemical Society, Perkin Transactions 1. Nr. 3, 1991, S. 567, doi:10.1039/p19910000567.
- ↑ Barbara Bisakowski, Xavier Perraud, Selim Kermasha: Characterization of Hydroperoxides and Carbonyl Compounds Obtained by Lipoxygenase Extracts of Selected Microorganisms. In: Bioscience, Biotechnology, and Biochemistry. Band 61, Nr. 8, Januar 1997, S. 1262–1269, doi:10.1271/bbb.61.1262.
- ↑ G. A. Veldink, G. J. Garssen, J. F. G. Vliegenthart, J. Boldingh: Positional specificity of corn germ lipoxygenase as a function of pH. In: Biochemical and Biophysical Research Communications. Band 47, Nr. 1, April 1972, S. 22–26, doi:10.1016/S0006-291X(72)80004-4.
- ↑ C. E. Eriksson, Karin Leu: Gas chromatographic separation of linoleic acid hydroperoxides as trimethylsilyl ethers of methyl hydroxystearates. In: Lipids. Band 6, Nr. 2, Februar 1971, S. 144–146, doi:10.1007/BF02531332.




