Nitrite
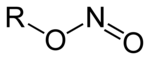
Salpetrigen Säure
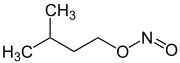
Nitrite sind Salze (M+NO2−, M: einwertiges Kation) und Ester (R–O–N=O, R: organischer Rest) der salpetrigen Säure HNO2. Von den Estern der salpetrigen Säure sind die isomeren Nitroverbindungen (R-NO2) abzugrenzen, bei denen der organische Rest direkt am Stickstoff gebunden ist.
Beispiele
|
| ||||||||||||||||||||||
Struktur
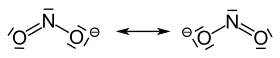
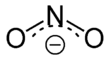
Das Nitrition hat eine gewinkelte Struktur mit einem Bindungswinkel von 115°. Die beiden mesomeren Grenzstrukturen zeigt die Abbildung:
Vorkommen
Nitritionen werden durch chemische Reaktion von nitrosen Gasen mit Sauerstoff und Feuchte der Luft (siehe saurer Regen) sowie im Boden in Gewässern und in Kläranlagen von Nitritbakterien (Nitrosomonas) durch Oxidation aus Ammoniumionen unter Verbrauch von Sauerstoff gebildet. Sie sind dabei beim Eiweißabbau das Zwischenprodukt bei der vollständigen Oxidation des Ammonstickstoffs zu Nitrat (Nitrifikation). Sie entstehen auch unter anaeroben Bedingungen durch bakterielle Reduktion aus Nitrat-Ionen (Nitratreduktase).
Ein hoher Gehalt an Nitriten im Wasser weist auf eine starke Belastung des Wassers mit Stickstoffverbindungen hin.[1]
In der Industrie können bei der Behandlung von Metalloberflächen, bei galvanischen Prozessen und bei der Reinigung stickoxidhaltiger Abgase giftige nitrithaltige Abwässer anfallen, die vor einer Entsorgung aufbereitet werden müssen.[2]
Verwendung
Als Lebensmittelzusatzstoffe dürfen Nitrite in Form von Kalium- (E 249) und Natriumnitrit (E 250) als Farbstabilisatoren im Nitritpökelsalz verwendet werden. Jedoch wird Nitrit auch illegal z. B. zum Färben von Thunfischen verwendet.[3]
Bei der Wurstproduktion ist die Verwendung von Nitriten vorgeschrieben, da es die Entwicklung des hochgefährlichen Botulismus-Bakteriums Clostridium botulinum verhindert. In der Schweiz gibt es keine solche Vorschrift. Luftgetrocknete Fleischwaren wie Parmaschinken oder Chorizo benötigen kein Nitrit.
Bei höheren Temperaturen können zusammen mit Eiweißbestandteilen der Nahrung Nitrosamine gebildet werden, die als kanzerogen (krebserregend) gelten. Daher sollten gepökelte Fleischwaren nie gegrillt werden.
Giftigkeit
Nitrite sind toxisch. Das Nitrition reagiert mit den Eisenatomen in eisenhaltigen Enzymen der Zellatmung sowie des Hämoglobins. Letzteres wird durch Nitrit zu Methämoglobin oxidiert (siehe auch Methämoglobinämie), wodurch die Fähigkeit zum Sauerstofftransport verloren geht. Ferner sind Nitrite an der Bildung kanzerogener Nitrosamine beteiligt.
Auch für Fische und andere Wassertiere ist Nitrit bei Konzentrationen über 0,1 mg/l[4] giftig, wobei eine starke Abhängigkeit vom pH-Wert des Wassers besteht, da nur die Salpetrige Säure durch die Kiemen in den Körper gelangen kann. Die LD50 (akute Giftigkeit) für Salpetrige Säure liegt für alle Süßwasser-Fischarten übereinstimmend um 0,01 mg/l. Einen weiteren Weg in den Fisch finden Nitrit-Ionen durch einen aktiven Transportmechanismus, der eigentlich der Aufnahme von Chloridionen dient, wenn deren Konzentration im Wasser deutlich unter ca. 15 mg/l liegt. Im Meerwasser ist Nitrit weitaus weniger giftig. Durch den aktiven Transportmechanismus, der Aufnahme von Chloridionen, steht diese aktive Aufnahme in Konkurrenz zur Nitritaufnahme. Bei einer Chloridkonzentration von 20 g/l und einer Konzentration von 1 mg/l Nitrit kommen auf ein Nitrit-Ion 25.000 Chloridionen. Diese verdrängen jedwedes Nitrit, sodass Nitrit in deutlich geringerem Maß aufgenommen wird.[5]
Organische Nitrite wirken im Körper als Stickstoffmonoxid-Donatoren und verfügen dadurch über dessen Wirkung, die über einen second-messenger-Mechanismus eine Entspannung der glatten Muskulatur und eine Vasodilatation herbeiführen. Bei Überdosierung auch therapeutisch genutzter Nitrite kann es zu starkem Abfall des Blutdrucks, Kreislaufkollaps bis hin zum Schock kommen. Nitrite wie Isobutylnitrit und Amylnitrit werden unter dem Namen Poppers als Aphrodisiaka inhaliert.
Aufbereitung nitrithaltiger Abwässer
Für die Beseitigung der Nitrite aus Abwässern, bevor diese in einen Vorfluter oder die Abwasserkanalisation eingeleitet werden, sind diverse Verfahren möglich.[6] Nachfolgend die wichtigsten Verfahren:
- Behandlung der Abwässer mit oxidativen Chemikalien. Hierfür sind Hypochlorite und Peroxide geeignet. Wichtig bei der Umsetzung ist der pH-Wert. Bei schwach sauren Bedingungen ist die Reaktionsgeschwindigkeit hoch und erfolgt quantitativ nach folgenden Gleichungen:
oder
Im basischen Bereich verlaufen die Reaktionen dagegen sehr langsam, während im stark sauren Bereich bei pH < 2,0 nitrose Gase gebildet werden. Die Gleichung für letztere Reaktion ist wie folgt:
Nachteilig bei der Verwendung von Hypochlorit zur Aufbereitung ist die Aufsalzung des Wassers mit Chloriden und Nitraten. Weiterhin können organische Halogenverbindungen(AOX) der Kohlenwasserstoffe (KW) entstehen, wenn die Wässer KW enthalten. Bei Einsatz von Peroxiden besteht die Gefahr einer katalytischen Zersetzung durch Metalle oder Metallsalze. Hierdurch kann ein unwirtschaftlicher Peroxid-Verbrauch verursacht werden.
- Eine weitere Möglichkeit für die Entfernung von Nitrite ist der Abbau mit Amidosulfonsäure oder Harnstoff. Der Abbau, der zur Reduktion der Nitrite führt, erfolgt für die Sulfonsäure nach den Gleichung:
und entsprechend für Harnstoff:
Bei der Verwendung von Amidosulfonsäure ist die Bildung von Sulfaten und freier Säure zu beachten. Letztere erfordert eine Neutralisation, so dass der Gehalt an Salzen im behandelten Abwasser vergrößert wird. Weiterhin können Stickoxide bei ungünstigen Verhältnissen gebildet werden. Diese Nachteile treten bei Verwendung von Harnstoff nicht auf, wenn verhindert wird, dass nitrose Gase ausgasen. Dies ist erreichbar, wenn der Abbau in einem geschlossenen Reaktor durchgeführt wird. Hierbei kann gleichzeitig auch Ammonium (NH4+) nach folgender Gleichung mit abgebaut werden:[7]
Die Verwendung von Harnstoff ist ökologisch günstig, da als Endprodukte nur die Gase Stickstoff und Kohlenstoffdioxid und Wasser entstehen. Eine Salzanreicherung der Abwässer wird vermieden.
Nachweis
Nitrit lässt sich mittels einer Farbreaktion nachweisen. Dazu versetzt man die wässrige Probe mit wenig Lunges Reagenz (Saure, bedingt haltbare Lösung von Sulfanilsäure und α-Naphthylamin) nach der Reaktion von Johann Peter Grieß von 1858[8]. Rotviolettfärbung durch den gebildeten Azofarbstoff zeigt Nitrit an.
Diese Reaktion wird in weiterentwickelter Form auch durch photometrische Messung zur quantitativen Bestimmung von Nitrit z. B. in Wasser verwendet. Sie ist in der DIN EN 26 777 (bis 1993: DIN 38 405 D10) normiert.
Siehe auch
Weblinks
Einzelnachweise
- ↑ Dietmar Kunath: Nitrite. In: Claus Schaefer, Torsten Schröer (Hrsg.): Das große Lexikon der Aquaristik. Eugen Ulmer, Stuttgart 2004, ISBN 3-8001-7497-9, S. 708.
- ↑ Gerhard Gutekunst, Waldemar Mzyk. In: WLB Wasser, Luft und Boden. 1–2, 1991, S. 39.
- ↑ Gesundheitsdepartement des Kantons Basel-Stadt: Illegales Färben von Thunfischfleisch. In: gd.bs.ch. 28. Mai 2019, abgerufen am 28. Mai 2019.
- ↑ Dietmar Kunath: Nitrite. 2004.
- ↑ Armin Glaser: Ratgeber Meerwasserchemie. 2008, Rüdiger Latka Verlag, ISBN 978-3-9810570-2-7.
- ↑ Gerhard Gutekunst, Waldemar Mzyk. In: WLB Wasser, Luft und Boden. 1–2, 1991, S. 39–40.
- ↑ Gerhard Gutekunst, Waldemar Mzyk. In: WLB Wasser, Luft und Boden. 1–2, 1991, S. 40.
- ↑ Griess, Peter: Bemerkungen zu den Abhandlungen der HH. Weselsky und Benedikt „Über einige Azoverbindungen“. Berichte der Deutschen Chemischen Gesellschaft, Jg. 12, 1879, S. 426–428.