Triadimenol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Triadimenol | ||||||||||||||||||
| Andere Namen |
α-tert-Butyl-β-(4-chlorphenoxy)-1H-1,2,4-triazol-1-ethanol | ||||||||||||||||||
| Summenformel | C14H18ClN3O2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer bis grauer Feststoff mit phenolartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 295,77 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Triadimenol ist ein Gemisch von vier isomeren chemischen Verbindungen aus der Gruppe der Conazole bzw. Triazole.
Gewinnung und Darstellung
Triadimenol kann durch eine Meerwein-Ponndorf-Verley-Reduktion von Triadimefon mit Aluminiumisopropanolat hergestellt werden.[4]

Eigenschaften
Triadimenol ist ein brennbarer weißer bis grauer Feststoff mit phenolartigem Geruch, der praktisch unlöslich in Wasser ist. Es hat einen Flammpunkt von 100 °C und zersetzt sich bei Erhitzung über 150 °C.[1] Triadimenol ist stabil gegenüber Hydrolyse bei pH-Werten von 4, 7 and 9 und unterliegt in geringem Maße der Photolyse.[2] Die oxidative Zersetzung unter Luft startet beim Erhitzen bei Temperaturen oberhalb von 200 °C. Hauptprodukte der Zersetzung sind 4-Chlorphenol, 4-Chlorbenzaldehyd, 5-Chlor-2-hydroxybenzaldehyd, 5-Chlorbenzofuran, 4-Chlor-4-ethoxybenzol, 1-Ethyl-1H-pyrrol-2,5-dion und 2,2-Dimethylpropionsäure-4-chlorphenylester.[5][6]
Stereochemie
Triadimenol enthält zwei Stereozentren in α-Position und β-Position:
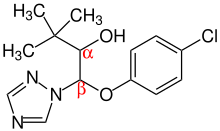
Damit gibt es insgesamt vier Stereoisomere. Das technische Produkt besteht zu 70 bis 85 % aus dem racemischen Diastereoisomer A [(αR,βS) + (αS,βR)], das Diastereoisomer B [(αR,βR) + (αS,βS)] liegt hingegen zwischen 15 und 30 % vor:[7]
| Stereoisomere von Triadimenol | |
|---|---|
 (αR,βS)-Stereoisomer |
 (αS,βR)-Stereoisomer |
 (αR,βR)-Stereoisomer |
 (αS,βS)-Stereoisomer |
Verwendung
Triadimenol ist ein systemisches Fungizid mit breitem Wirkungsspektrum. Es hemmt die Ergosterol- und Gibberellin-Biosynthese und damit die Rate der Zellteilung.[2] Die Verbindung wurde 1978 auf den Markt gebracht.[8]
Zulassung
In der Europäischen Union konnte Triadimenol bei Pflanzenschutzmitteln seit September 2009 für Anwendungen als Fungizid verwendet werden.[9] Da kein Antrag auf Erneuerung der Wirkstoffgenehmigung gestellt wurde, endete die EU-Genehmigung für Triadimenol als Wirkstoff in Pflanzenschutzmitteln, gemäß Durchführungsverordnung (EU) Nr. 540/2011, am 31. August 2019 durch Zeitablauf.[7]
In Deutschland galt gemäß Pflanzenschutzgesetz noch eine Abverkaufsfrist bis zum 29. Februar 2020 und eine Aufbrauchfrist bis zum 28. Februar 2021.[10]
In der Schweiz endete die Aufbrauchsfrist für das einzig mit diesem Wirkstoff erhältliche Pestizid am 31. Oktober 2020.[7]
Der von Bayer hergestellte Wirkstoff wird auch auf dem brasilianischen und südafrikanischen Markt vertrieben.[11]
Einzelnachweise
- ↑ a b c d e f g h i j k l m Eintrag zu Triadimenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ a b c FAO: FAO SPECIFICATIONS AND EVALUATIONS FOR AGRICULTURAL PESTICIDES - Triadimenol (PDF; 524 kB).
- ↑ Eintrag zu α-tert-butyl-β-(4-chlorophenoxy)-1H-1,2,4-triazole-1-ethanol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 31. Dezember 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag zu Triadimenol in der Hazardous Substances Data Bank (via PubChem), abgerufen am 12. April 2013.
- ↑ Monika Borucka, Maciej Celiński: Thermal Degradation and Combustion Behavior of Antifungal Pesticides: Triadimenol and Tebuconazole. In: Chem. Eng. Trans. 77 (2019) 139–144, doi:10.3303/CET1977024, PDF.
- ↑ Monika Borucka, Maciej Celinski, Kamila Sałasinska, Agnieszka Gajek: Identification of volatile and semi-volatile organic compounds emitted during thermal degradation and combustion of triadimenol. In: J. Therm. Anal. Calorim. 139 (2020) 1493–1506, doi:10.1007/s10973-019-08531-y (Open Access).
- ↑ a b c Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Triadimenol in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 6. April 2023.
- ↑ Horst Börner, Klaus Schlüter: Pflanzenkrankheiten und Pflanzenschutz. Springer, 2009, ISBN 3-540-49068-X, S. 496 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Richtlinie 2008/125/EG der Kommission vom 19. Dezember 2008 (PDF) zur Änderung der Richtlinie 91/414/EWG des Rates zwecks Aufnahme von Aluminiumphosphid, Calciumphosphid, Magnesiumphosphid, Cymoxanil, Dodemorph, 2,5-Dichlorbenzoesäuremethylester, Metamitron, Sulcotrion, Tebuconazol und Triadimenol als Wirkstoffe.
- ↑ Bundesamt für Verbraucherschutz und Lebensmittelsicherheit: Widerruf der Zulassung von Pflanzenschutzmitteln mit dem Wirkstoff Triadimenol zum 31. August 2019. In: bvl.bund.de. 8. Mai 2019, archiviert vom am 10. Mai 2019; abgerufen am 10. Mai 2019.
- ↑ Benjamin Luig, Fran Paula de Castro und Alan Tygel (beide Campanha Permanente Contra os Agrotóxicos e Pela Vida), Lena Luig (INKOTA-netzwerk), Simphiwe Dada (Khanyisa), Sarah Schneider (MISEREOR) und Jan Urhahn (Rosa-Luxemburg-Stiftung): Gefährliche Pestizide. (PDF; 2,4 MB) von Bayer und BASF – ein globales Geschäft mit Doppelstandards. Rosa-Luxemburg-Stiftung, INKOTA-netzwerk, Bischöfliches Hilfswerk Misereor u. a., April 2020, abgerufen am 25. April 2020.


