Ammoniumsulfat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ammoniumsulfat | |||||||||||||||
| Andere Namen | ||||||||||||||||
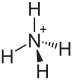
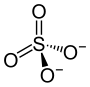
| Summenformel | (NH4)2SO4 | |||||||||||||||
| Kurzbeschreibung |
geruch- und farbloser kristalliner Feststoff[3] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 132,14 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,77 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser:
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−1180 kJ·mol−1[7] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Ammoniumsulfat (E 517) ist eine chemische Verbindung aus der Gruppe der Salze, das bei der Reaktion von Ammoniak mit Schwefelsäure gebildet wird. Ein nahe verwandtes Salz ist Ammoniumhydrogensulfat.
Vorkommen[Bearbeiten | Quelltext bearbeiten]
In der Natur ist Ammoniumsulfat als seltenes Mineral unter dem Namen Mascagnin bekannt.[8]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Ammoniumsulfat ist zwar wenig hygroskopisch, aber gut in Wasser löslich. Die wässrigen Lösungen reagieren schwach sauer. Wie viele Ammoniumsalze kann es mit Natriumnitrit oder Kaliumnitrit schon bei Raumtemperatur unter Flammenbildung oder sogar explosionsartig reagieren.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Ammoniumsulfat wird immer gebildet, wenn gasförmiges, in Wasser oder anderen Lösungsmitteln gelöstes Ammoniak mit Lösungen von Schwefelsäure in Kontakt kommt. Das ist z. B. der Fall, wenn bei der Herstellung von Stadtgas durch Kohlevergasung das ammoniakhaltige Rohgas einer Gaswäsche mit verdünnter Schwefelsäure unterzogen wird um das als Düngemittel wertvolle Ammoniumsulfat zu bilden.
Industriell relevant ist die Produktion von Ammoniumsulfat bei der Herstellung von Caprolactam, da dieses als Koppelprodukt anfällt.
Auch andere ungewöhnliche Umsetzungen wurden entwickelt, um aus den einfachen, billigen Ausgangs- oder Abfallprodukten Ammoniak, Kohlenstoffdioxid und Wasser mit Hilfe von Gips das wertvolle Ammoniumsulfat herzustellen.[9]
Verwendung[Bearbeiten | Quelltext bearbeiten]

Ammoniumsulfat ist ein wichtiger Düngemittelzusatzstoff. In biologischen Kläranlagen dient es als ein Bestandteil von Nährstoffmischungen für die Mikroorganismenkulturen.
In der chemischen Industrie dient es unter anderem als Fällungsmittel für Eiweiß, als Flotationsmittel und zur Herstellung von Feuerlöschpulver und Flammschutzmitteln. Die Lederindustrie verwendet es für Beizen, die Papierindustrie für schwer entflammbare Papiere.
In der Biochemie wird Ammoniumsulfat zum Aussalzen von Proteinen (Ammoniumsulfat-Fällung) verwendet. Daneben werden Zellen und Gewebe zum Schutz der RNA vor Degradation in einer gesättigten Ammoniumsulfat-Lösung konserviert.
Ammoniumsulfat wird auch Lebensmitteln als Trägersubstanz für andere Zusatzstoffe zugesetzt. In der EU ist es als Lebensmittelzusatzstoff der Nummer E 517 ausschließlich als Trägerstoff bzw. Trägerlösemittel zugelassen.
In der Weinherstellung setzt man Ammoniumsulfat als Bestandteil von Nährsalzmischungen für Hefen ein, vor allem um deren Zellvermehrung während der Gärung zu begünstigen.
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu E 517: Ammonium sulphate in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 11. August 2020.
- ↑ Eintrag zu AMMONIUM SULFATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. Februar 2020.
- ↑ a b c d e f g h i j Eintrag zu Ammoniumsulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Dezember 2019. (JavaScript erforderlich)
- ↑ Robert K. Scopes: Protein Purification. Springer Science & Business Media, 2013, ISBN 978-1-4757-2333-5, S. 81
- ↑ Europäisches Arzneibuch 10.0. Deutscher Apotheker Verlag, 2020, ISBN 978-3-7692-7515-5, S. 704.
- ↑ Datenblatt Ammoniumsulfat bei Merck, abgerufen am 19. Januar 2011.
- ↑ PAETEC Formelsammlung Ausgabe 2003, S. 116.
- ↑ Malcolm Back, William D. Birch, Michel Blondieau und andere: The New IMA List of Minerals – A Work in Progress – Updated: November 2018. (PDF 1753 kB) In: cnmnc.main.jp. IMA/CNMNC, Marco Pasero, November 2018, abgerufen am 27. März 2019 (englisch, Arcanite siehe S. 11).
- ↑ Patent DE112012002980T5: Verfahren zur Herstellung von hochreinem Ammoniumsulfat und Calcit unter Verwendung von Gips. Angemeldet am 13. Juli 2012, veröffentlicht am 22. Mai 2014, Anmelder: Korea Institute of Geoscience and Mineral Resources, Erfinder: Kyung Won Ryu, Myung Kyu Lee, Young Nam Jang.

