Aromatische-L-Aminosäure-Decarboxylase
| Aromatische-L-Aminosäure-Decarboxylase | ||
|---|---|---|

| ||
| dimer, Human | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 338 bis 480 Aminosäuren (je nach Isoform) | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | Pyridoxalphosphat | |
| Isoformen | 4 | |
| Bezeichner | ||
| Gen-Namen | DDC AADC | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 4.1.1.28, Lyase | |
| Reaktionsart | Decarboxylierung | |
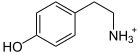
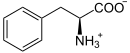
| Substrat | DOPA, L-5-Hydroxy-Trp, L-Trp | |
| Produkte | Dopamin, Serotonin, Tryptamin + CO2 | |
| Vorkommen | ||
| Homologie-Familie | AADC | |
| Übergeordnetes Taxon | Chordatiere | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 1644 | 13195 |
| Ensembl | ENSG00000132437 | ENSMUSG00000020182 |
| UniProt | P20711 | O88533 |
| Refseq (mRNA) | NM_000790 | NM_001190448 |
| Refseq (Protein) | NP_000781 | NP_001177377 |
| Genlocus | Chr 7: 50.46 – 50.57 Mb | Chr 11: 11.81 – 11.9 Mb |
| PubMed-Suche | 1644 | 13195
|
Aromatische-L-Aminosäure-Decarboxylase (AADC), auch DOPA-Decarboxylase (DDC) genannt, ist der Name für Enzyme in Chordatieren, die die Biosynthese von Dopamin, Serotonin und Tryptamin mittels Decarboxylierung katalysieren. Als Entdecker gilt der deutsche Pharmakologe Peter Holtz.
Mutationen am entsprechenden DDC-Gen und folgender Mangel am Enzym führen zu Mangel an den entsprechenden Neurotransmittern und Katecholaminen.[1] AADC ist gentherapeutisches Target für die Behandlung der Parkinson-Krankheit; Phase I-Studien wurden 2008 erfolgreich abgeschlossen. Patienten mit polyendokriner Autoimmunerkrankung Typ I (APS1) zeigen zum Teil Autoantikörper auf AADC. Manche Varianten der AADC sind assoziiert mit Nikotinabhängigkeit.[2][3][4][5]
Katalysierte Reaktionen[Bearbeiten | Quelltext bearbeiten]
L-DOPA wird zu Dopamin decarboxyliert (Katecholamin-Synthese).
5-Hydroxy-L-Tryptophan wird zu Serotonin decarboxyliert.
L-Tryptophan wird zu Tryptamin decarboxyliert.
L-Histidin wird zu Histamin decarboxyliert.
L-Tyrosin wird zu Tyramin decarboxyliert (Tyrosin-Abbau).
L-Phenylalanin wird zu Phenethylamin decarboxyliert (L-Phe-Abbau).
Weitere Funktionen[Bearbeiten | Quelltext bearbeiten]
Obwohl allgegenwärtig im Körper, zeigte eine Studie mit Mäusen besonders hohe Konzentrationen an AADC in Nieren und Darm, und festgestellte Unterschiede in der Nieren-Konzentration zwischen Männchen und Weibchen könnten für entsprechende Geschlechtsunterschiede im Natriumhaushalt verantwortlich sein. Es ist wichtig für die Entwicklung der Geschmacksknospen in Mäusen.[6][7]
AADC spielt eine Rolle im Signalweg des Androgenrezeptors.[8]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ UniProt P20711
- ↑ Eberling JL, Jagust WJ, Christine CW, et al: Results from a phase I safety trial of hAADC gene therapy for Parkinson disease. In: Neurology. 70. Jahrgang, Nr. 21, Mai 2008, S. 1980–3, doi:10.1212/01.wnl.0000312381.29287.ff, PMID 18401019.
- ↑ Mochizuki H, Yasuda T, Mouradian MM: Advances in gene therapy for movement disorders. In: Neurotherapeutics. 5. Jahrgang, Nr. 2, April 2008, S. 260–9, doi:10.1016/j.nurt.2008.01.005, PMID 18394568.
- ↑ Candeloro P, Voltattorni CB, Perniola R, et al: Mapping of human autoantibody epitopes on aromatic L-amino acid decarboxylase. In: J. Clin. Endocrinol. Metab. 92. Jahrgang, Nr. 3, März 2007, S. 1096–105, doi:10.1210/jc.2006-2319, PMID 17200166.
- ↑ Yu Y, Panhuysen C, Kranzler HR, et al: Intronic variants in the dopa decarboxylase (DDC) gene are associated with smoking behavior in European-Americans and African-Americans. In: Hum. Mol. Genet. 15. Jahrgang, Nr. 14, Juli 2006, S. 2192–9, doi:10.1093/hmg/ddl144, PMID 16740595.
- ↑ López-Contreras AJ, Galindo JD, López-García C, Castells MT, Cremades A, Peñafiel R: Opposite sexual dimorphism of 3,4-dihydroxyphenylalanine decarboxylase in the kidney and small intestine of mice. In: J. Endocrinol. 196. Jahrgang, Nr. 3, März 2008, S. 615–24, doi:10.1677/JOE-07-0564, PMID 18310457.
- ↑ Seta Y, Kataoka S, Toyono T, Toyoshima K: Immunohistochemical localization of aromatic L-amino acid decarboxylase in mouse taste buds and developing taste papillae. In: Histochem. Cell Biol. 127. Jahrgang, Nr. 4, April 2007, S. 415–22, doi:10.1007/s00418-006-0257-3, PMID 17211625.
- ↑ Margiotti K, Wafa LA, Cheng H, Novelli G, Nelson CC, Rennie PS: Androgen-regulated genes differentially modulated by the androgen receptor coactivator L-dopa decarboxylase in human prostate cancer cells. In: Mol. Cancer. 6. Jahrgang, 2007, S. 38, doi:10.1186/1476-4598-6-38, PMID 17553164, PMC 1904238 (freier Volltext).