Fischer-Base
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
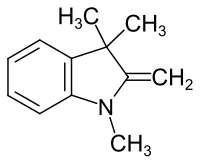
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Fischer-Base | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C12H15N | ||||||||||||||||||
| Kurzbeschreibung |
rote Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 173,25 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,979 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt |
−10 bis −8 °C[2] | ||||||||||||||||||
| Siedepunkt |
239 °C[2] | ||||||||||||||||||
| Löslichkeit |
wenig in Wasser (0,5 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Die Fischer-Base (Trivialname, systematisch 1,3,3-Trimethyl-2-methylenindolin) ist eine chemische Verbindung aus der Gruppe der Indoline. Die Darstellung durch Methylierung von 2-Methylindol wurde 1887 durch Emil Fischer beschrieben, der jedoch annahm, dass es sich dabei um ein Trimethyldihydrochinolin handelt.[3][4] Die korrekte Struktur wurde 1898 unabhängig voneinander von Giuseppe Plancher und Karl Brunner publiziert.[5][6]
Die Fischer-Base wird als Startmaterial für die Herstellung von Farbstoffen eingesetzt.[7]
Synthese
[Bearbeiten | Quelltext bearbeiten]Die Synthese der Fischer-Base erfolgt in einer Fischer-Indol-Synthese durch die Kondensation von 3-Methylbutanon 1 und Phenylhydrazin 2 in alkoholischem Zinkchlorid. Das Phenylhydrazon 3 wird unter Abspaltung von Ammoniak zum 2,3,3-Trimethylindolenin 4 cyclisiert. Die Methylierung mit Dimethylsulfat 5 führt zu dem 1,2,3,3-Tetramethyl-3H-indolium-Salz 6, das unter basischen Bedingungen in die Fischer-Base 7 übergeht.[7] Die Methylierung des indolischen Stickstoffatoms wurde in der Originalliteratur mittels Methyliodid durchgeführt.

Anwendung
[Bearbeiten | Quelltext bearbeiten]Die Fischer-Base ist ein Ausgangsstoff bei der Herstellung verschiedener Methinfarbstoffe, beispielsweise Basic Yellow 28.[8]

Die doppelte Methylsubstitution in der 3-Position des Indolkörpers der Fischer-Base sorgt in den Polymethin-Farbstoffen für Stabilität, da hierdurch die üblicherweise herrschende Nucleophilie dieser Position blockiert ist. Dies ist auch notwendig, um die Regioselektivität bei der Herstellung der Polymethin-Farbstoffe zu gewährleisten, da die Methinketten hier in Form eines elektrophilen synthetischen Äquivalenz wie etwa vinylogen Ameisensäureestern eingebracht werden.[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Datenblatt 1,3,3-Trimethyl-2-methylen-indolin bei Sigma-Aldrich, abgerufen am 9. Juli 2021 (PDF).
- ↑ a b c d e Eintrag zu 1,3,3-Trimethyl-2-methylenindolin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. November 2022. (JavaScript erforderlich)
- ↑ Emil Fischer, Albert Steche: Verwandlung der Indole in Hydrochinoline. In: Justus Liebigs Annalen der Chemie. Band 242, Nr. 3, 1887, S. 348–366, doi:10.1002/jlac.18872420309.
- ↑ Emil Fischer, Jacob Meyer: Methylirung der Indole. In: Berichte der deutschen chemischen Gesellschaft. Band 23, Nr. 2, 1890, S. 2628–2634, doi:10.1002/cber.189002302159.
- ↑ Giuseppe Plancher: Ueber die Methylirung der Indole. In: Berichte der deutschen chemischen Gesellschaft. Band 31, Nr. 2, 1898, S. 1488–1499, doi:10.1002/cber.18980310238.
- ↑ Karl Brunner: Ueber die E. Fischer'sche, aus Methylketol und Jodmethyl darstellbare Base. In: Berichte der deutschen chemischen Gesellschaft. Band 31, Nr. 1, 1898, S. 612–615, doi:10.1002/cber.189803101128.
- ↑ a b c Eberhard Breitmaier, Günther Jung: Organische Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur. 5. Auflage. Georg Thieme Verlag, Stuttgart 2005, ISBN 3-13-541505-8, S. 718 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Basic Yellow 28: CAS-Nr.: 54060-92-3, EG-Nr.: 258-946-7, ECHA-InfoCard: 100.053.570, PubChem: 9570625, ChemSpider: 7845092, Wikidata: Q27254755.

