Hexachloroiridiumsäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
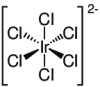
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Hexachloroiridiumsäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | H2[IrCl6] | |||||||||||||||
| Kurzbeschreibung |
schwarzer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 406,95 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
1,02 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in Wasser und Alkohol[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Hexachloroiridiumsäure ist eine anorganische chemische Verbindung aus der Gruppe der Säuren.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Hexachloroiridiumsäure kann durch Reaktion einer Lösung von Ammoniumhexachloroiridat mit Chlor gewonnen werden.[3]
Es kann auch durch Auflösung von Ammoniumhexachloroiridat(IV) in Königswasser und anschließende Erwärmung gewonnen werden.[2]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Hexachloroiridiumsäure ist ein schwarzer Feststoff.[1] Sie liegt in Form von langen rötlichschwarzen Nadeln vor, die leicht löslich in Wasser und Alkohol mit rotbrauner Farbe sind.[2]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Hexachloroiridiumsäure katalysiert die elektrochemische Synthese von Polyanilin auf der Oberfläche von Nichtedelmetallelektroden. Sie bei der Bildung von Iridium-substituierten Polyoxometallaten vom Dawson- und Keggin-Typ verwendet, indem die freie Stelle der Lacunary-Precursoren wieder aufgefüllt wird.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Datenblatt Hydrogen hexachloroiridate(IV) hydrate, 99.98% trace metals basis bei Sigma-Aldrich, abgerufen am 17. Februar 2018 (PDF).
- ↑ a b c Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 683.
- ↑ Georg Brauer: Handbook of Preparative Inorganic Chemistry. Elsevier, 2012, ISBN 978-0-323-16129-9, S. 1593 (eingeschränkte Vorschau in der Google-Buchsuche).


