Iodbenzoesäuren
| Iodbenzoesäuren | |||||||
| Name | 2-Iodbenzoesäure | 3-Iodbenzoesäure | 4-Iodbenzoesäure | ||||
| Andere Namen | o-Iodbenzoesäure | m-Iodbenzoesäure | p-Iodbenzoesäure | ||||
| Strukturformel | 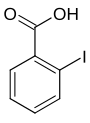
|

|

| ||||
| CAS-Nummer | 88-67-5 | 618-51-9 | 619-58-9 | ||||
| PubChem | 6941 | 12060 | 12085 | ||||
| Summenformel | C7H5IO2 | ||||||
| Molare Masse | 248,02 g·mol−1 | ||||||
| Aggregatzustand | fest | ||||||
| Kurzbeschreibung | gelborange Nadeln | ||||||
| Schmelzpunkt | 160–162 °C[1] | 185–187 °C[2] | 270–273 °C[3] | ||||
| pKs-Wert[4] | 2,86 | 3,85 | – | ||||
| GHS- Kennzeichnung |
|
|
| ||||
| H- und P-Sätze | 302‐315‐318‐335 | keine H-Sätze | 315‐332‐335 | ||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | |||||
| 261‐280‐305+351+338 | keine P-Sätze | 261‐305+351+338 | |||||
| Gefahrstoff- kennzeichnung [1][2][3] |
| ||||||
| R-Sätze | 22‐37/38‐41 | keine R-Sätze | 36/37/38 | ||||
| S-Sätze | 26‐39 | 22‐24/25 | 26‐36 | ||||
Die Iodbenzoesäuren bilden in der Chemie eine Stoffgruppe, die sich sowohl von der Benzoesäure als auch vom Iodbenzol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter Carboxygruppe (–COOH) und Iod (–I) als Substituenten. Durch deren unterschiedliche Anordnung ergeben sich drei Konstitutionsisomere mit der Summenformel C7H5IO2.
Darstellung
Die Iodbenzoesäuren können aus den entsprechenden Aminobenzoesäuren durch Diazotierung und anschließende Zugabe von Iodidlösungen dargestellt werden (Sandmeyer-Reaktion).[5]
Eigenschaften
Die Iodbenzoesäuren sind kristalline Feststoffe.[6][7][8] 2-Iodbenzoesäure bildet orangerote Kristalle.[5] Die Schmelzpunkte unterscheiden sich deutlich. Die 4-Iodbenzoesäure, die die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt. Die Iodbenzoesäuren weisen aufgrund des −I-Effekts des Iodsubstituenten eine höhere Acidität im Vergleich zur Benzoesäure auf. Die pKs-Werte sind daher entsprechend niedriger (Benzoesäure: 4,20[4]).
Einzelnachweise
- ↑ a b c Datenblatt 2-Iodobenzoic acid bei Sigma-Aldrich (PDF).
- ↑ a b c Datenblatt 3-Iodobenzoic acid bei Sigma-Aldrich (PDF).
- ↑ a b c Datenblatt 4-Iodobenzoic acid bei Sigma-Aldrich (PDF).
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b Universität Wien, Praktikum "Spezielle Synthesechemie": Darstellung von 2-Iodbenzoesäure aus Anthranilsäure. (PDF; 690 kB), S. 6.
- ↑ Harold P. Klug: „The Crystal Structure of Ortho-Iodobenzoic Acid“, in: J. Am. Chem. Soc., 1933, 55 (4), S. 1430–1436; doi:10.1021/ja01331a015.
- ↑ Harold P. Klug, Edward Mack Jr., F. C. Blake: „The Crystal Structure of Meta-Iodobenzoic Acid“, in: J. Am. Chem. Soc., 1929, 51 (10), S. 2880–2888; doi:10.1021/ja01385a003.
- ↑ Russell G. Baughman, Janet E. Nelson: „The structure of p-iodobenzoic acid, C7H5IO2“, in: Acta Crystallographica C, 1984, 40, S. 204–206; doi:10.1107/S0108270184003607.
Siehe auch


