Körnerzelle

Körnerzelle oder Granularzelle (Neuronum granuliforme) bezeichnet einen morphologischen Typus kleiner Nervenzellen mit kugelförmigem Perikaryon, dem zahlreiche Interneuronen verschiedener Hirnregionen zugehören.
Körnerzellen kommen besonders dicht in der Rinde von Großhirn und Kleinhirn vor. Im Endhirn findet man sie insbesondere neokortikal in der Schicht IV (Stratum granulosum internum) des Isocortex der Großhirnrinde, daneben archikortikal im Hippocampus und paläokortikal im Riechkolben (Bulbus olfactorius). Die meisten der Körnerzellen liegen allerdings im Kleinhirn (Cerebellum), im Stratum granulosum des zerebellaren Kortex.[1]
Körnerzellen im Kortex des Großhirns[Bearbeiten | Quelltext bearbeiten]
Die Körnerzellen der Großhirnrinde treten als hemmende (inhibitorische) oder als erregende (exzitatorische) Interneuronen auf, solche mit sphärisch verzweigtem Dendritenbaum werden auch als Sternzellen bezeichnet.[1] Zumeist sind es multipolare Neuronen mit apolarer Ausrichtung, die also im Gegensatz zu Pyramidenzellen nicht zur Hirnoberfläche orientiert sind. Ihr Zellkörper ist etwa 10 µm groß und damit deutlich kleiner als jener von Pyramidenzellen. Im Unterschied zu diesen haben sie nur relativ kurze Axone, die Kontakte mit Neuronen in der Nachbarschaft bilden, anderen Interneuronen oder benachbarten Pyramidenzellen. Die Dendriten bestimmter Körnerzellen können feine postsynaptische Ausstülpungen tragen, wie Dornen aussehende sogenannte Dornenfortsätze, insbesondere die von lokal erregenden Körnerzellen bzw. Sternzellen. Der Großteil von Körnerzellen im Cortex cerebri sind jedoch dornenlose inhibitorische (GABA-erge) Interneuronen.
Körnerzellen im Isocortex[Bearbeiten | Quelltext bearbeiten]
Im sechsschichtig aufgebauten Isocortex findet man diese Neuronen in der innere Körnerzellschicht genannten Lamina IV. Besonders stark ausgeprägt ist diese Schicht in jenen kortikalen Regionen, die von sensiblen oder sensorischen Projektionen aus spezifischen Kernen des Thalamus erreicht werden. Hierzu gehören beispielsweise Hirnrindenareale, die auch als primärer somatosensorischer Cortex, visueller Cortex (Sehrinde) oder auditiver Cortex (Hörrinde) bezeichnet werden.
Körnerzellen im Allocortex[Bearbeiten | Quelltext bearbeiten]
Archikortikale Körnerzellen im Hippocampus[Bearbeiten | Quelltext bearbeiten]
Der Gyrus dentatus der Hippocampusformation empfängt kortikale Afferenzen über seine Molekularschicht (Stratum moleculare) und verschaltet diese auf die Körnerzellschicht (Stratum granulare). Ihre Hauptzellen sind erregende, glutamaterge Körnerzellen, deren Dendriten in der molekularen Schicht verzweigen. Neben diesen exzitatorischen Körnerzellen gibt es auch hier eine Reihe unterschiedlicher hemmender, GABAerger Interneuronen.
Paläokortikale Körnerzellen im Riechkolben[Bearbeiten | Quelltext bearbeiten]
Die Körnerzellen im Riechkolben (Bulbus olfactorius) arbeiten mit GABA als Neurotransmitter und bilden somit hemmende (inhibitorische) Synapsen aus. Ihre Dendriten empfangen erregende Signale von den Axonkollateralen der Mitralzellen und auch von deren Dendriten. Hemmende Einflüsse werden über rückläufige zentrifugale Axone aus sekundären olfaktorischen Arealen des Riechhirns vermittelt.
Diese Körnerzellen sind durch ein bipolares und dornenbesetztes Dendritenwerk charakterisiert, ein eigentliches Axon besitzen sie nicht. Während der dorsale Dendritenbaum axodendritische Kontakte aufnimmt, gehen die Dendritenverzweigungen des ventralen Pols dendrodendritische Kontakte mit Mitralzellen ein. Hierbei kommt es als Besonderheit auch zu reziproken Synapsen, bei denen neben der inhibitorischen vom Körnerzelldendriten auf den Mitralzelldendriten auch umgekehrt eine synaptische Verknüpfung mit exzitatorischer Wirkung auf die Dendritenregion der Körnerzelle seitens des Mitralzelldendriten gebildet wird.[1]
Körnerzellen im Kortex des Kleinhirns[Bearbeiten | Quelltext bearbeiten]
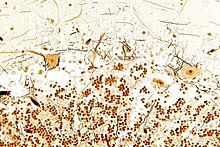
Im Bild oben umgeben von Glia hellbraun angefäbt die Fortsätze und großen Zellkörper weniger Purkinjezellen in engem Kontakt mit einigen schwarz angefärbten Fortsätzen von Korbzellen.
Darunter die Lage der zerebellaren Körnerzellen, die bei Säugetieren über 50 % aller Neuronen stellen.

Die Körnerzellen in der Rinde des Kleinhirns stellen die größte Anzahl aller Neuronen im Säugetiergehirn. Beim Menschen sind über 50 % aller Nervenzellen zerebellare Körnerzellen. Sie liegen in der sogenannten Körnerzellschicht (Stratum granulosum) der Kleinhirnrinde (Cortex cerebelli). Jede dieser Zellen verfügt über vier kurze unverzweigte Dendriten und sendet jeweils ein Axon in die Molekularschicht der Kleinhirnrinde. Dort verzweigen sich die Axone der Körnerzellen und bilden die sogenannten Parallelfasern aus. Diese wirken über glutamaterge Synapsen erregend auf Purkinjezellen.
Zerebellare Körnerzellen werden durch Signale vorgeschalteter afferenter Neuronen erregt, deren Axone als Moosfasern in die Kleinhirnrinde aufsteigen und in der Körnerschicht mit Synapsen enden. Gewöhnlich stehen die Körnerzellen hier aber unter dem hemmenden Einfluss von Golgizellen und feuern in vivo mit niedriger Frequenz (0,2–0,5 Hz). Durch sensorische Stimulation, beispielsweise von Tasthaaren, erzeugte Signale afferenter Neuronen des Hirnstamms können postsynaptisch Körnerzellen zu „Paketen“ von Aktionspotentialen („bursts“) anregen. Dafür reichen Serien mit geringen EPSP-Strömen aus, doch einzelne spontan gebildete Signale von Moosfasern vermögen dies allein bei reduzierter Inhibition. Körnerzellen im Cortex cerebelli vereinen so eine hohe Sensitivität mit einem guten Signal-Rausch-Verhältnis.[2]
Räumliche Architektur des Chromatins[Bearbeiten | Quelltext bearbeiten]
Zerebellare Körnerzellen von Säugetieren wie Maus und Mensch zeigen in der räumlichen Architektur ihres Chromatins charakteristische Muster, die den Zugriff auf ihr Genom im Zellkern beeinflussen. Neben der Kompartimentierung von in-/aktivem Chromatin im frühen postnatalen Leben bilden sich hierbei auch weitreichende intrachromosomale Kontakte (10-100Mb) und spezifische interchromosomale Kontakte heraus, die sich während des gesamten Lebens umbilden und restrukturieren. Diese Dynamik der 3D-Genomarchitektur wird durch zelltypspezifische Gene moduliert, nicht durch CpG-Methylierungen allgemeinerer Ebene.[3]
Bei der normalen Entwicklung des Gehirns und seiner neuronalen Netze wirken verschiedene Proteine mit, die innerhalb einzelner Zellen durch Veränderungen der Chromatinstruktur die Expression bestimmter Gene fördern oder unterdrücken. Ein Beispiel hierfür ist das Protein Chd4,[4] das im Kleinhirn von Mäusen die Synaptogenese zwischen Körnerzellen und Purkinje-Zellen durch Chromatin-Remodellierung moduliert, indem es die Zugänglichkeit zu genomweiten Promotoren und Enhancern unter physiologischen Entwicklungsbedingungen unterdrückt.[5]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Benninghoff: Makroskopische und mikroskopische Anatomie des Menschen, Bd. 3. Nervensystem, Haut und Sinnesorgane. Urban und Schwarzenberg, München 1985, ISBN 3-541-00264-6, S. 301 und S. 373 bzw. S. 559.
- ↑ Paul Chadderton, Troy W. Margrie, Michael Häusser: Integration of quanta in cerebellar granule cells during sensory processing. In: Nature. 428, 2004, S. 856, doi:10.1038/nature02442.
- ↑ Longzhi Tan, Jenny Shi, Siavash Moghadami, Bibudha Parasar, Cydney P. Wright, Yunji Seo, Kristen Vallejo, Inma Cobos, Laramie Duncan, Ritchie Chen, Karl Deisseroth: Lifelong restructuring of 3D genome architecture in cerebellar granule cells. In: Science. Band 381, Nr. 6662, 8. September 2023, ISSN 0036-8075, S. 1112–1119, doi:10.1126/science.adh3253 (science.org [abgerufen am 16. Januar 2024]).
- ↑ Legüe, Marcela: Relevancia de los mecanismos epigenéticos en el neurodesarrollo normal y consecuencias de sus perturbaciones | Revista Médica Clínica Las Condes. 2022, abgerufen am 16. Januar 2024 (spanisch).
- ↑ Jared V. Goodman, Tomoko Yamada, Yue Yang, Lingchun Kong, Dennis Y. Wu, Guoyan Zhao, Harrison W. Gabel, Azad Bonni: The chromatin remodeling enzyme Chd4 regulates genome architecture in the mouse brain. In: Nature Communications. Band 11, Nr. 1, 9. Juli 2020, ISSN 2041-1723, S. 3419, doi:10.1038/s41467-020-17065-z (nature.com [abgerufen am 16. Januar 2024]).