γ-Aminobuttersäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
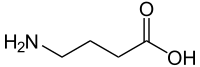
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | γ-Aminobuttersäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C4H9NO2 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 103,12 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
sehr gut in Wasser (1300 g·l−1 bei 25 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Die γ-Aminobuttersäure (englisch gamma-Aminobutyric acid, abgekürzt GABA), seltener auch 4-Aminobuttersäure oder Piperidinsäure genannt, ist ein Amin der Buttersäure. Die Stellung der Aminogruppe am γ-Kohlenstoffatom bezüglich der Carboxygruppe unterscheidet sie von den proteinogenen α-Aminosäuren.
Biologisch ist γ-Aminobuttersäure oder GABA bei vielen Lebewesen ein bedeutender endogener Botenstoff, der als biogenes Amin durch Decarboxylierung der Glutaminsäure gebildet wird, insbesondere von Nervenzellen. Im Gehirn erwachsener Säugetiere ist GABA so der hauptsächliche Neurotransmitter von inhibitorischen (hemmenden) Synapsen; während fetaler Reifungsphasen ist die Wirkung hingegen oft exzitatorisch (erregend).
Bindung an GABAerge Makromoleküle[Bearbeiten | Quelltext bearbeiten]
GABA bindet an spezifische biologische Makromoleküle. So aktiviert es ionotrope und metabotrope GABA-Rezeptoren; es passiert Membranen über plasmalemmale (GAT) und vesikuläre (VGAT) Transporter und ist Substrat einer spezifischen Transaminase.
- GABAA-Rezeptoren: Der GABA-Rezeptor vom Typ A ist ein Chlorid-Ionenkanal, der über Liganden gesteuert wird. GABA bindet als orthosterischer Ligand an eine extrazellulär gelegene Domäne des Rezeptors, der als Transmembran-Protein die Zellmembran durchspannt und aus fünf Protein-Untereinheiten zusammengesetzt ist. Diese Bindungsstelle liegt an den Schnittstellen β+/α- der Untereinheiten; die elektrophysiologischen Eigenschaften von GABA sind stark abhängig vom jeweiligen Aufbau des Rezeptortyps.
- Der Bindungskomplex wurde 2018 mittels Elektronenmikroskopie näher charakterisiert. In überwiegend gestreckter Konformation bindet GABA mit seiner Aminogruppe an die Schleifen B und C der Rezeptoruntereinheit beta (β), und zwar über eine Salzbrücke mit Glutaminsäure (β-E155), eine aromatische Kation–Pi-Bindung (β-Y205) und eine Wasserstoffbrückenbindung (β-Y97). Die Carboxygruppe des Liganden geht zwei Wasserstoffbrückenbindungen ein (β-T202 und α-T129) und bildet mit der Rezeptoruntereinheit alpha (α) eine Salzbrücke über Arginin (α-R66). In seiner Lage stabilisiert wird der Ligand durch umgebende Aromaten (β-Y205, β-F200, β-Y157, α-F64). Schwach bindet GABA auch an homologe Bindungsstellen α+/β-.[5] GABA stabilisiert gebunden die geöffnete Konformation des Rezeptors, erhöht damit den Anionen-Einstrom, und führt so zu einer entsprechenden Änderung des Membranpotentials.
- GABAA-ρ-Rezeptoren: Der einst als GABAC-Rezeptor bezeichnete Typ ist ebenfalls ein ionotroper Rezeptor. Er unterscheidet sich vom GABAA-Rezeptor dadurch, dass er aus ρ-Untereinheiten zusammengesetzt ist. An diesem Rezeptor sind pharmakologische Substanzen wie Benzodiazepine und Barbiturate unwirksam.
- GABAB-Rezeptoren: Dieser Typ gehört zu den G-Protein-gekoppelten Rezeptoren (metabotrop). Er vermittelt eine erhöhte Öffnungswahrscheinlichkeit von Kalium-Ionenkanälen. Dies führt zur Hyperpolarisation der Zellmembran. Weiterhin wird die Offenwahrscheinlichkeit für Calcium-Kanäle vermindert. Dieser Effekt macht sich hauptsächlich präsynaptisch bemerkbar, hier wird die Transmitter-Ausschüttung vermindert.
Biosynthese und Metabolismus[Bearbeiten | Quelltext bearbeiten]
GABA entsteht in eukaryoten Zellen durch Decarboxylierung von Glutaminsäure mittels der Glutamat-Decarboxylase (GAD). Damit kann in einem Schritt aus einem exzitatorischen Neurotransmitter ein inhibitorischer werden.

Rezeptoren für GABA finden sich häufig an Nervenzellen und führen meist zu einer Hemmung (Inhibition) der Nervenleitung. Der Neurotransmitter GABA kann vom präsynaptischen Neuron wieder aufgenommen und in synaptischen Vesikeln zur Wiederverwendung gespeichert werden. Ein Teil der als Transmitter in den synaptischen Spalt ausgeschütteten GABA-Moleküle wird von benachbarten Gliazellen aufgenommen. Dort wird die Aminogruppe mit Hilfe der GABA-Transaminase (GABA-T) auf Pyridoxalphosphat und weiter auf α-Ketoglutarat übertragen; der dabei entstandene Succinat-Semialdehyd wird von der Succinat-Semi-Aldehyd-Dehydrogenase zu Bernsteinsäure metabolisiert. Dieser in der Mitochondrienmatrix lokalisierte und als GABA-Nebenweg (GABA shunt) bezeichnete Metabolismus ist nicht auf das Gehirn beschränkt, sondern besteht auch in den meisten anderen Organen.[6] Mit Hilfe des Transaminasehemmers Vigabatrin kann dieser Abbauweg im Gehirn gehemmt werden.[7] In der Folge entsteht ein erhöhter GABA-Spiegel mit vor epileptischen Anfällen schützender Wirkung.[8]
GABA-Rezeptoren spielen während der Entwicklung von neuronalen Strukturen im Gehirn eine bedeutsame Rolle. Interessanterweise wirkt GABA hierbei beim Fötus zunächst bei neu entstandenen neuronalen Verbindungen oft exzitatorisch und trägt so zu deren Etablierung bei.
Peripher aufgenommene GABA passiert die Blut-Hirn-Schranke nur in geringer Menge.[9][10] Eine Wirksamkeit von GABA als Medikament ist nicht nachgewiesen; die Einnahme, zu welchem Zweck auch immer, ist deshalb nicht zu empfehlen.
Rolle von GABA in der Bauchspeicheldrüse[Bearbeiten | Quelltext bearbeiten]
GABA wirkt als inhibitorischer Transmitter in der Bauchspeicheldrüse, indem es in den Langerhans-Inseln die Glucagonsekretion der Alphazellen hemmt.[11][12] Bakteriell im Darm von überfütterten, adipösen Mäusen produzierte GABA verbesserte die Insulinsekretion und verringerte die Akkumulation von Fettgewebe in der Darmwand.[13]
GABA-Modulatoren[Bearbeiten | Quelltext bearbeiten]
Für die Grundlagenforschung werden als GABA-Antagonisten neben dem synthetischen Wirkstoff Gabazin die Pflanzengifte Picrotoxin der Scheinmyrte und Bicucullin der Herzblumen verwendet. Als GABA-Agonist ist Muscimol, eines der Gifte des Fliegenpilzes relevant. Als Agonist in der medizinischen Anwendung dient der Wirkstoff Baclofen.[14][15][16]
Literatur[Bearbeiten | Quelltext bearbeiten]
- H. Lüllmann, K. Mohr, M. Wehling: Pharmakologie und Toxikologie. 15. Auflage, Thieme Verlag, 2003, ISBN 3-13-368515-5.
- Klaus Aktories, Ulrich Förstermann, Franz Hofmann, Wolfgang Forth: Allgemeine und spezielle Pharmakologie und Toxikologie. 9. Auflage. Urban & Fischer, 2004, ISBN 3-437-42521-8.
- Robert M. Julien: Drogen und Psychopharmaka. Spektrum Akademischer Verlag, 1997, ISBN 3-8274-0044-9.
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu AMINOBUTYRIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. April 2020.
- ↑ a b c Datenblatt γ-Aminobutyric acid bei Sigma-Aldrich, abgerufen am 26. April 2011 (PDF).
- ↑ a b c Eintrag zu Gamma-aminobutyric acid in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 25. März 2021. (Seite nicht mehr abrufbar)
- ↑ a b W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 5-88.
- ↑ Phulera S, Zhu H, Yu J, Claxton DP, Yoder N, Yoshioka C, Gouaux E: Cryo-EM structure of the benzodiazepine-sensitive α1β1γ2S tri-heteromeric GABAA receptor in complex with GABA. In: Elife. 7. Jahrgang, Juli 2018, doi:10.7554/eLife.39383, PMID 30044221, PMC 6086659 (freier Volltext).
- ↑ Arne Schousbou und Helle S. Waagepetersen: Gamma-Aminobutyric Acid (GABA) in Encyclopedia of Neuroscience: Reference Module in Neuroscience and Biobehavioral Psychology 2009, S. 511–515, doi:10.1016/B978-0-12-809324-5.02341-5.
- ↑ Michel Jung und Charles Danzin, New developments in enzyme-activated imhibitors of pyridoxal phosphate-dependent enzymes of therapeutic interest. in Design of Enzyme Inhibitors as Drugs S. 257–293, Oxford University Press 1989.
- ↑ Lippert, B., Metcalf, B.W., Jung, M.J. und Casara, P.: 4-aminohex-5-enoic acid, a selective catalytic inhibitor of 4-aminobutyrate aminotransferase in mammalian brain. European Journal of Biochemistry Nr. 74, S. 441 (1977).
- ↑ W.H. Oldendorf: Brain uptake of radiolabeled amino acids, amines, and hexoses after arterial injection. In: Am.J. Physiology Band 221 (1971), Nr. 6, S. 1629–1639. doi:10.1152/ajplegacy.1971.221.6.1629.
- ↑ Ada McVean, GABA supplements, glorious, gimmicky or just garbage? in McGill, Office of Science and Society. Separating sense from nonsense 11. Oktober 2018.
- ↑ Anna Wendt, Bryndis Birnir, Karsten Buschard, Jesper Gromada, Albert Salehi, Sabine Sewing, Patrik Rorsman und Matthias Braun: Glucose Inhibition of Glucagon Secretion From Rat α-Cells Is Mediated by GABA Released From Neighboring β-Cells in Diabetes Nr. 53, S. 1038 (2004).
- ↑ Patrik Rorsman, Per-Olof Berggren, Krister Bokvist, Hans Ericson, Hanns Möhler, Claes-Göran Östenson und Paul A. Smith: Glucose-inhibition of glucagon secretion involves activation of GABA A-receptor chloride channels in Nature Nr. 341, S. 233(1989).
- ↑ Catherine Stanton et al.: Gamma-aminobutyric acidproducing lactobacilli positively affect metabolism and depressivelike behaviour in a mouse model of metabolic syndrome. In: Nature Research, Scientific Reports Nr. 9, 2019, S. 16323, doi:10.1038/s41598-019-51781-x.
- ↑ W. Bautista, J. Aguilar, J. E. Loeza-Alcocer, R. Delgado-Lezama: Pre- and postsynaptic modulation of monosynaptic reflex by GABAA receptors on turtle spinal cord. In: The Journal of physiology. Band 588/14, Juli 2010, S. 2621–2631, doi:10.1113/jphysiol.2010.188979, PMID 20519320, PMC 2916992 (freier Volltext).
- ↑ Makoto Taketani: Advances in Network Electrophysiology. Springer Science & Business Media, 2006, ISBN 978-0-387-25858-4, S. 305 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ B. H. Liu, G. K. Wu, R. Arbuckle, H. W. Tao, L. I. Zhang: Defining cortical frequency tuning with recurrent excitatory circuitry. In: Nature Neuroscience. Band 10, Nummer 12, Dezember 2007, S. 1594–1600, doi:10.1038/nn2012, PMID 17994013, PMC 2447868 (freier Volltext).
