N-Hydroxysuccinimid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | N-Hydroxysuccinimid | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C4H5NO3 | |||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser kristalliner Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 115,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
N-Hydroxysuccinimid (NHS, in Strukturformeln meist als HOSu abgekürzt, nach IUPAC 1-Hydroxy-2,5-pyrrolidindion) ist das N-Hydroxy-Derivat von Succinimid. Die Substanz wird in organischen Synthesen vor allem zur Herstellung sogenannter NHS-Ester verwendet.
Darstellung[Bearbeiten | Quelltext bearbeiten]
N-Hydroxysuccinimid entsteht bei der Umsetzung von Bernsteinsäureanhydrid mit Hydroxylamin.[4] Die Reaktion findet nach Verdampfen des als Lösungsmittel eingesetzten Methanols im Vakuum bei 160 °C in der Schmelze statt. Nach mehrfacher Extraktion des viskosen Rückstandes wird das Reinprodukt in 46%iger Ausbeute erhalten.
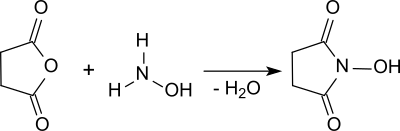
Eine einfachere Variante nutzt statt Hydroxylamin das leichter zu handhabende Hydroxylamin-hydrochlorid im Gemisch mit Bernsteinsäureanhydrid, das im Rotationsverdampfer unter Vakuum auf 160 °C erhitzt wird, bis kein Wasser mehr aus der Schmelze entweicht. Nach mehrmaliger Extraktion mit mehreren organischen Lösungsmitteln fällt reines NHS in 44%iger Ausbeute an.[5]
Eine weitere Verfahrensvereinfachung ist die Reaktion von Hydroxylamin und Bernsteinsäureanhydrid in Wasser (vermutlich zunächst unter Bildung der Monohydroxamsäure) und anschließender Ringschluss unter Wasserabspaltung im Vakuum bei 105 °C, die unter Vermeidung aufwendiger Extraktionen in 70–78%iger Ausbeute zum NHS-Monohydrat führt.

Zweistündiges Erhitzen des Monohydrats unter Vakuum (ca. 1 mbar) auf 80–90 °C liefert reines wasserfreies N-Hydroxysuccinimid in quantitativer Ausbeute.[6]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
N-Hydroxysuccinimid ist ein farb- und geruchloser kristalliner Feststoff. Es ist in Wasser leicht löslich und zeigt darin eine schwach saure Reaktion. NHS ist ein schwaches Oxidationsmittel. Oberhalb von 180 °C wird mittels DSC eine stark exotherme Zersetzung beobachtet. Die bestimmte Zersetzungswärme beträgt −174 kJ·mol−1 bzw. −1510 kJ·kg−1.[7][8]
Verwendung[Bearbeiten | Quelltext bearbeiten]
In chemischen und biochemischen Synthesen ist N-Hydroxysuccinimid eine vielseitig und häufig eingesetzte Verbindung.
Durch Umsetzung mit einer Carbonsäure und einem Aktivierungs-Reagenz, wie beispielsweise Dicyclohexylcarbodiimid (DCC) oder 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimid (EDC), werden damit NHS-Ester hergestellt. NHS-Ester sind „aktivierte Carbonsäuren“ und reagieren leicht mit Aminofunktionen – beispielsweise von Peptiden oder Proteinen –, die deutlich nukleophiler als Alkohole sind.[9]
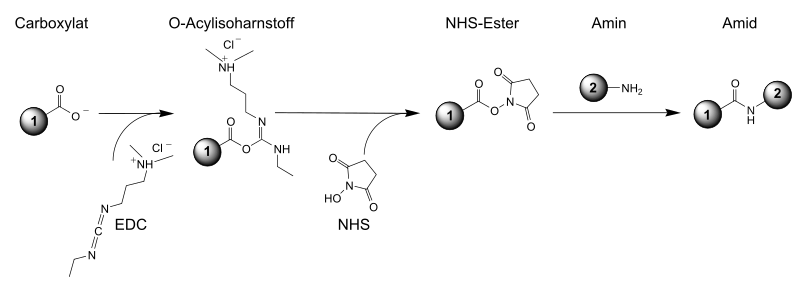
NHS-Ester sind relativ hydrolysestabil.[10]
Ähnliche Reagenzien zur Aktivierung von Carbonsäuren sind N-Hydroxysulfosuccinimid-Natriumsalz, 1-Hydroxybenzotriazol (HOBT), 1-Hydroxy-7-azabenzotriazol (HOAT) und Pentafluorphenol.
Die oxidierenden Eigenschaften von NHS können zur Ruthenium-katalysierten Umwandlung endständiger Alkine in Carbonsäure-Derivate genutzt werden.[11]
Die Verwendung von NHS zur Herstellung von Aktivestern wurde erstmals 1963 von George W. Anderson, Joan E. Zimmerman und Francis M. Callahan beschrieben.[12]
Toxikologie[Bearbeiten | Quelltext bearbeiten]
N-Hydroxysuccinimid ist im Tiermodell Maus und Ratte weder kanzerogen noch teratogen. Bei der Backhefe Saccharomyces cerevisiae löst es keine mitotischen Genveränderungen aus.[13]
Literatur[Bearbeiten | Quelltext bearbeiten]
- B. Lygo: Handbook of Reagents for Organic Synthesis – Activating Agents and Protecting Groups. A. J. Pearson und W. R. Roush (Hrsg.), Verlag Wiley, 1999, S. 225–227.
- C. A. Montalbetti und V. Falque: Amide bond formation and peptide coupling. In: Tetrahedron 61, 2005, S. 10827–10852, doi:10.1016/j.tet.2005.08.031.
- V. A. Shibnev u. a.: N-hydroxysuccinimide esters in the synthesis of collagen-type structures. In: Russian Chemical Bulletin 18, 1969, S. 2367–2370, doi:10.1007/BF00906511.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu N-HYDROXYSUCCINIMIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 16. September 2021.
- ↑ a b c d Datenblatt N-Hydroxysuccinimid bei Merck, abgerufen am 25. Dezember 2019.
- ↑ Eintrag zu Succinimid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- ↑ Patent US2816111: Sulfonic acid derivatives. Angemeldet am 9. Februar 1954, veröffentlicht am 10. Dezember 1957, Anmelder: Farbenfabriken Bayer AG, Erfinder: R. Wegler, F. Grewe, K. Mehlhose.
- ↑ G.W. Anderson, J.E. Zimmerman, F.M. Callahan: The use of esters of N-hydroxysuccinimide in peptide synthesis. In: J. Am. Chem. Soc. Band 86, Nr. 9, 1964, S. 1839–1842, doi:10.1021/ja01063a037.
- ↑ Patent US5493031: N-Hydroxysuccinimide monohydrate. Angemeldet am 16. Juni 1994, veröffentlicht am 20. Februar 1996, Anmelder: PPG Industries, Inc., Erfinder: C. Govindan.
- ↑ Grewer, T.; Klais, O.: Exotherme Zersetzung - Untersuchungen der charakteristischen Stoffeigenschaften, VDI-Verlag, Schriftenreihe "Humanisierung des Arbeitslebens", Band 84, Düsseldorf 1988, ISBN 3-18-400855-X, S. 9.
- ↑ P.G. Urben; M.J. Pitt: Bretherick's Handbook of Reactive Chemical Hazards. 8. Edition, Vol. 1, Butterworth/Heinemann 2017, ISBN 978-0-08-100971-0, S. 328.
- ↑ M. A. Gauthier u. a.: Synthese funktioneller Polymere durch polymeranaloge Reaktionen. In: Angew Chem 121, 2009, S. 50–60, doi:10.1002/ange.200801951.
- ↑ E. Pedone u. a.: An information rich biomedical polymer library. In: J Mater Chem 13, 2003, S. 2825–2837. doi:10.1039/B306857A.
- ↑ B. M. Trost u. a.: Ruthenium-katalysierte Reaktionen – eine Schatzkiste für atomökonomische Umwandlungen. In: Angew Chem 117, 2005, S. 6788–6825, doi:10.1002/ange.200500136.
- ↑ G. W. Anderson u. a.: N-Hydroxysuccinimide Esters in Peptide Synthesis. In: JACS 85, 1963, S. 3039, doi:10.1021/ja00902a047.
- ↑ H. Dannenberg: N-Hydroxy-succinimid, eine nicht krebserzeugende N-Hydroxy-Verbindung. In: Zeitschrift für Krebsforschung und Klinische Onkologie 76, 1971, S. 216–218, doi:10.1007/BF00303565.