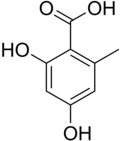
Orsellinsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Orsellinsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H8O4 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Nadeln[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 168,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Die Orsellinsäure ist eine organische Säure und leitet sich von der Benzoesäure ab, indem zwei Hydroxygruppen und eine Methylgruppe als Substituenten hinzugefügt werden. Sie gehört damit u. a. zur Gruppe der Phenolsäuren. Sie steht ferner der Untergruppe der Dihydroxybenzoesäuren nahe und unterscheidet sich konkret von der β-Resorcylsäure (2,4-Dihydroxybenzoesäure) durch eine hinzugefügte Methylgruppe. Sie spielt eine Rolle in der Biochemie der Flechten sowie von Aspergillus- und Penicillium-Stämmen, aus denen sie isoliert werden kann. Die Biosynthese in diesen Organismen verläuft über den Polyketidweg.
Vorkommen und Biosynthese
[Bearbeiten | Quelltext bearbeiten]Orsellinsäure entsteht u. a. als Sekundärmetabolit in Aspergillus nidulans.[3][4][5] Dabei kann die Bildung der Orsellinsäure spezifisch durch den engen, physischen Kontakt zu benachbarten Bakterien oder einer Mutation im Signalosome-Komplex ausgelöst werden.[6] Orsellinsäure, Orcin und Penicillinsäure finden sich in Kulturen von Penicillium fennelliae.[7] Sie spielt eine Rolle in der Biochemie der Flechten, aus denen sie isoliert werden kann.[8]
Die Biosynthese verläuft über den Polyketidweg, bei dem aus einfachen, Coenzym-A-aktivierten Acylgruppen (zumeist Acetyl-CoA), ein Tetraketid aufgebaut und anschließend cyclisiert wird.[9][10]
Für A. nidulans wurde das Gen für eine Orsellinsäure-Synthase (OAS) identifiziert, die einer typischen, nichtreduzierenden Polyketidsynthase ähnelt. Die Sequenzinformation gibt Hinweise auf verschiedene Domänen, die für den Biosyntheseweg eine Rolle spielen. So hat man Sequenzmotive einer startenden Acyltransferase, einer Ketosynthase, einer Acyltransferase, einer Produkttemplatdomäne, einem Acylträgerprotein und einer Thioesterase identifiziert. Dadurch vermutet man, dass aus drei Molekülen Malonyl-CoA und einem enzymgebundenen ein Molekül Orsellinsäure gebildet werden kann. Acetyl-CoA dient als Startmolekül für die Synthese, alle weiteren Schritte finden enzymgebunden statt.

Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Synthese gelingt durch Michael-Addition von Acetessigester an Crotonsäureethylester mit anschließender intramolekularer Dieckmann-Kondensation. Dabei bildet sich Dihydroorsellinsäureethylester. Dehydrierung und Esterspaltung führen zur Orsellinsäure.

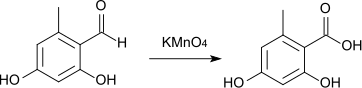
Orsellinsäure kann auch durch Oxidation von Orcylaldehyd hergestellt werden.[11][12]
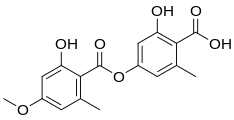
Sie kann gleichfalls dargestellt werden, wenn man Everninsäure (CAS-Nummer: 570-10-5) und Ramalsäure (CAS-Nummer: 500-37-8) mit Bariumhydroxid erhitzt und damit die Esterbindung spaltet.[13]
-
Everninsäure
-
Ramalsäure
Eine weitere Synthese geht vom Orcin aus, das mit Magnesiummethylcarbonat in DMF carboxyliert wird.[14]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Orsellinsäure bildet farblose Kristalle in Form von Nadeln.[1] Sie zersetzt sich bei rascher Erwärmung bei 176 °C[13] und decarboxyliert dabei zu Orcin.[15]

Literatur
[Bearbeiten | Quelltext bearbeiten]- Adolf Sonn: „Eine neue Synthese der Orsellinsäure (5. Mitteilung über Flechtenstoffe.)“, in: Berichte der deutschen chemischen Gesellschaft, 1928, 61 (5), S. 926–927 (doi:10.1002/cber.19280610508).
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-182.
- ↑ a b Datenblatt Orsellinsäure bei Alfa Aesar, abgerufen am 30. April 2017 (Seite nicht mehr abrufbar).
- ↑ Volker Schroeckh, Kirstin Scherlach, Hans-Wilhelm Nützmann, Ekaterina Shelest, Wolfgang Schmidt-Heck, Julia Schuemann, Karin Martin, Christian Hertweck, Axel A. Brakhage: „Intimate bacterial-fungal interaction triggers biosynthesis of archetypal polyketides in Aspergillus nidulans“, in: Proceedings of the National Academy of Sciences of the United States of America, 2009, 106 (34), S. 14558–14563 (doi:10.1073/pnas.0901870106; PDF).
- ↑ Michael Ramm: Bakterien induzieren Wirkstoffsynthese in Pilzen. Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie - Hans-Knöll-Institut (HKI), Pressemitteilung vom 21. August 2009 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 24. August 2015.; www.organische-chemie.ch: 25. August 2009.
- ↑ James F. Sanchez, Yi-Ming Chiang, Edyta Szewczyk, Ashley D. Davidson, Manmeet Ahuja, C. Elizabeth Oakley, Jin Woo Bok, Nancy Keller, Berl R. Oakley, Clay C. C. Wang: „Molecular genetic analysis of the orsellinic acid/F9775 gene cluster of Aspergillus nidulans“, in: Mol Biosyst., 2010, 6 (3), S. 587–593 (doi:10.1039/B904541D; PMID 20174687; PMC 2903553 (freier Volltext)).
- ↑ Krystyna Nahlik, Marc Dumkow, Özgür Bayram, Kerstin Helmstaedt, Silke Busch, Oliver Valerius, Jennifer Gerke, Michael Hoppert, Elke Schwier, Lennart Opitz, Mieke Westermann, Stephanie Grond, Kirstin Feussner, Cornelia Goebel, Alexander Kaever, Peter Meinecke, Ivo Feussner, Gerhard H. Braus: „The COP9 signalosome mediates transcriptional and metabolic response for hormones, oxidative stress protection and cell wall rearrangement during fungal development“, in: Molecular Microbiology, 2010, 78 (4), S. 964–979 (doi:10.1111/j.1365-2958.2010.07384.x).
- ↑ G. W. Eijk: „Isolation and identification of orsellinic acid and penicillic acid produced by Penicillium fennelliae Stolk“, in: Antonie van Leeuwenhoek, 1969, 35 (1), S. 497–504 (doi:10.1007/BF02219167).
- ↑ T. J. Nolan, J. Keane, V. E. Davidson: „Chemical constituents of the lichen Parmelia latissima Fee“, in: Scientific Proceedings of the Royal Dublin Society, Series A, 1940, 22, S. 237–239.
- ↑ Klaus Mosbach: „Die Biosynthese der Orsellinsäure und Penicillinsäure (I)“, in: Acta Chem. Scand., 1960, 14, S. 457–464 (PDF).
- ↑ Klaus Mosbach: „Die Rolle der Malonsäure in der Biosynthese der Orsellinsäure“, in: Naturwissenschaften, 1961, 48 (15), S. 525–525 (doi:10.1007/BF00595346).
- ↑ Kurt Hoesch: „Synthese der Orsellinsäure und der Everninsäure“, in: Berichte der deutschen chemischen Gesellschaft, 1913, 46 (1), S. 886–892 (doi:10.1002/cber.191304601116).
- ↑ Ying Kang, Yan Mei, Yuguo Du, Zhendong Jin: „Total Synthesis of the Highly Potent Anti-HIV Natural Product Daurichromenic Acid along with Its Two Chromane Derivatives, Rhododaurichromanic Acids A and B“, in: Organic Letters, 2003, 5 (23), S. 4481–4484 (PMID 14602030; (doi:10.1021/ol030109m).
- ↑ a b R. Russell, C. Kemmelmeier: „Neutral, alkaline and difference ultraviolet spectra of secondary metabolites from Penicillium and other fungi, and comparisons to published maxima from gradient high-performance liquid chromatography with diode-array detection“, in: Journal of Chromatography A, 1990, 511, S. 195–221 (doi:10.1016/S0021-9673(01)93285-6; PMID 2211911).
- ↑ J. Santesson: „Syntheses of Orsellinic Acid and Related Compounds“, in: Acta Chem. Scand., 1970, 24, S. 3373–3378 (PDF).
- ↑ R. Hegnauer: Chemotaxonomie der Pflanzen, Band 1: Thallophyten, Bryophyten; Pteridophyten und Gymnospermen, Birkhäuser Verlag, Basel 1962, S. 160 (eingeschränkte Vorschau in der Google-Buchsuche).