Radikalanionen
Radikalanionen sind Moleküle, die sowohl ein ungepaartes Elektron als auch eine negative Ladung aufweisen. Es handelt sich also gleichzeitig um Radikale und Anionen.
Natürliche Vertreter
[Bearbeiten | Quelltext bearbeiten]
Chinone, die 1,4-Benzochinon als Teilstruktur enthalten, beispielsweise Ubichinon und Plastochinon, sind wichtige Elektronenakzeptoren in biologischen Systemen. Dabei bildet sich zunächst durch Aufnahme eines Elektrons ein Radikalanion.[1] Superoxid ist ein Radikalanion, das durch Reduktion von molekularem Sauerstoff entsteht und ebenfalls verbreitet in biologischen Systemen gebildet wird. Da es hochreaktiv ist und auch mutagen wirken kann, muss es zur Vermeidung von Zellschäden abgebaut werden, was durch Superoxid-Dismutasen passiert.[2] Die blaue Farbe von Lasurit und Lapislazuli entsteht im Wesentlichen durch Trisulfid-Radikalanionen.[3]
Synthetische Vertreter
[Bearbeiten | Quelltext bearbeiten]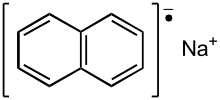
Polycyclische aromatische Kohlenwasserstoffe können unter geeigneten Bedingungen zwei Elektronen aufnehmen, wobei durch die Aufnahme des ersten Elektrons ein Radikalanion entsteht. Hergestellt werden diese Radikalanionen durch Reaktion eines entsprechenden Kohlenwasserstoffs mit Alkalimetallen (Lithium, Natrium, Kalium, Caesium). Geeignete aromatische Verbindungen, die eine solche Reaktion eingehen, sind beispielsweise Naphthalin, Anthracen, Perylen oder Biphenyl. Zum ersten Mal beschrieben wurde die Herstellung 1867 von Marcelin Berthelot, der Naphtalin mit Kalium schmolz. Aromaten-Radikalanionen können das aufgenommene Radikal wiederum auf andere Verbindungen übertragen. Daneben wirken sie als starke Basen. Beispielsweise können viele wenig acide Verbindungen wie Phenylacetylen, Acetylen, Fluoren oder Diphenylmethan mit Natriumnaphthalinid deprotoniert und dann mit Kohlenstoffdioxid zu einer Carbonsäure umgesetzt werden. So entsteht aus Acetylen Propiolsäure und aus Diphenylmethan Diphenylessigsäure. Durch Elektronenübertragung von Natriumnaphtalinid auf Alkylhalogenide entstehen Alkane und Alkene.[4]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Daniel A. Horke, Quansong Li, Lluís Blancafort, Jan R. R. Verlet: Ultrafast above-threshold dynamics of the radical anion of a prototypical quinone electron-acceptor. In: Nature Chemistry. Band 5, Nr. 8, August 2013, S. 711–717, doi:10.1038/nchem.1705.
- ↑ Irwin Fridovich: Superoxide Anion Radical (O·̄2), Superoxide Dismutases, and Related Matters. In: Journal of Biological Chemistry. Band 272, Nr. 30, Juli 1997, S. 18515–18517, doi:10.1074/jbc.272.30.18515.
- ↑ Sebastiano Ettore Spoto, Roberta Somma, Giuseppe Paladini, Francesco Caridi, Monica Interdonato, Domenico Majolino, Valentina Venuti: From lapis lazuli to synthetic ultramarines: a u-Raman spectroscopy investigation on the history and development of the Most Perfect Color. In: Proceedings of the 2022 IMEKO TC4 International Conference on Metrology for Archaeology and Cultural Heritage. IMEKO, Budapest 2023, doi:10.21014/tc4-arc-2022.079.
- ↑ N. L. Holy: Reactions of the radical anions and dianions of aromatic hydrocarbons. In: Chemical Reviews. Band 74, Nr. 2, 1. April 1974, S. 243–277, doi:10.1021/cr60288a005.