Tetrabromstearinsäure
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
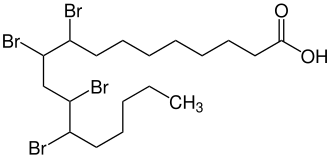
| |||||||||||||
| Ohne Stereochemie | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Tetrabromstearinsäure | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C18H32Br4O2 | ||||||||||||
| Kurzbeschreibung | |||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 600,1 g·mol−1 | ||||||||||||
| Aggregatzustand | |||||||||||||
| Schmelzpunkt |
114,7–115,2 °C (all RS racemat)[3] | ||||||||||||
| Löslichkeit |
| ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
9,10,12,13-Tetrabromstearinsäure ist eine bromierte und gesättigte Fettsäure.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Das Samenöl von Eremostachys moluccelloides (Familie Lippenblütler) enthält Tetrabromstearinsäure.[6]
Synthese
[Bearbeiten | Quelltext bearbeiten]Tetrabromstearinsäure kann durch Bromierung von Linolsäure hergestellt werden.[7]
Metabolismus und Toxikologie
[Bearbeiten | Quelltext bearbeiten]Der Metabolismus von Lipiden, die Tetrabromstearinsäure enthalten, wurde an Ratten untersucht. Dabei werden kürzerkettige Derivate gebildet und diese ins Körperfett sowie Fette von Herz und Leber eingebaut. Tetrabromstearinsäure wird insbesondere in der Leber akkumuliert. Der Verzehr dieser Fette führte zu Veränderungen am Herzen, inklusive einer gelben Verfärbung sowie zu Ödemen, außerdem zu einer Fettleber.[8]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Tetrabromstearinsäure ist ein Bestandteil bromierter Pflanzenöle. Diese werden zum Teil als Zusatzstoff in Softdrinks eingesetzt, unter anderem als Lösungsvermittler für andere hydrophobe Zutaten und zur Erzeugung einer Trübung („clouding agent“).[9]
Tetrabromstearinsäure ist ein wichtiges Intermediat bei der früher verwendeten Trennung von Linolsäure und Linolensäure durch Bromierung und Debromierung. Dabei wird das natürliche Fett zunächst bromiert, wobei aus Linolsäure Tetrabromstearinsäure entsteht. Die bromierten Fettsäuren können vergleichsweise einfach getrennt werden und bei Bedarf durch Reaktion mit elementarem Zink debromiert werden.[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Beilsteins Handbuch der Organischen Chemie. Vierte Auflage, Zweiter Band, 1942, S. 362 f, archive.org
- ↑ a b c Emil Abderhalden: Handbuch der Biochemischen Arbeitsmethoden. Zweiter Band, Urban & Schwarzenberg, 1910, online auf biodiversitylibrary.org.
- ↑ a b c d e Dictionary of Organic Compounds. Second Supplement, Sixth Edition, Chapman & Hall, ISBN 978-0-412-54120-9, S. 260.
- ↑ a b c Frank D. Gunstone, Fred B. Padley, John L. Harwood: The Lipid Handbook. Second Edition, Chapman & Hall, 1994, ISBN 0-412-43320-6, S. 581.
- ↑ a b Eintrag zu 9,10,12,13-TetrabromostearicSäure, >97.0% bei TCI Europe, abgerufen am 20. August 2023.
- ↑ S. D. Gusakova, A. U. Umarov: Dibromo- and tetrabromostearic acids in the seed oil of Eremostachys moluccelloides. In: Chemistry of Natural Compounds. Band 12, Nr. 6, November 1976, S. 645–650, doi:10.1007/BF00564950.
- ↑ a b Norman L. Matthews, Wallace R. Brode, J. B. Brown: Studies on the Chemistry of the Fatty Acids. VII. The Multiple Nature of the Linoleic and Linolenic Acids Prepared by the Bromination—Debromination Procedure. The Purification of These Acids by Repeated Low-Temperature Crystallization. In: Journal of the American Chemical Society. Band 63, Nr. 4, April 1941, S. 1064–1067, doi:10.1021/ja01849a048.
- ↑ Barbara A. Jones, Ian J. Tinsley, Glenn Wilson, Robert R. Lowry: Toxicology of brominated fatty acids: Metabolite concentration and heart and liver changes. In: Lipids. Band 18, Nr. 4, April 1983, S. 327–334, doi:10.1007/BF02534710.
- ↑ Paul Bendig, Lisa Maier, Walter Vetter: Brominated vegetable oil in soft drinks – an underrated source of human organobromine intake. In: Food Chemistry. Band 133, Nr. 3, August 2012, S. 678–682, doi:10.1016/j.foodchem.2012.01.058.
