„Kohlenstoffdisulfid“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Rjh (Diskussion | Beiträge) |
Rjh (Diskussion | Beiträge) |
||
| Zeile 72: | Zeile 72: | ||
=== Toxikologie === |
=== Toxikologie === |
||
Da Schwefelkohlenstoff gut fettlöslich ist, wird es über Lunge und Haut leicht aufgenommen. Eine längere Exposition führt zu Vergiftungserscheinungen: Die akute Schwefelkohlenstoffvergiftung äußert sich in Gesichtsrötung, euphorischen Erregungszuständen, dann Bewusstlosigkeit, Koma und Atemlähmung; die chronische Schwefelkohlenstoffvergiftung durch wiederholtes längeres Einatmen äußert sich in Kopfschmerzen, Schlaflosigkeit, Gedächtnis-, Seh- und Hörstörungen, Nervenentzündungen und Gefäßschäden.<ref name="Karlheinz Lohs, Ursula Stephan">{{Literatur| Autor=Karlheinz Lohs, Ursula Stephan | Titel=Fachlexikon Toxikologie | Verlag=Springer-Verlag | ISBN=978-3-540-27337-0 | Jahr=2008 | Online={{Google Buch | BuchID=HOsmBAAAQBAJ | Seite=401 }} | Seiten=401 }}</ref> |
Da Schwefelkohlenstoff gut fettlöslich ist, wird es über Lunge und Haut leicht aufgenommen. Eine längere Exposition führt zu Vergiftungserscheinungen: Die akute Schwefelkohlenstoffvergiftung äußert sich in Gesichtsrötung, euphorischen Erregungszuständen, dann Bewusstlosigkeit, Koma und Atemlähmung; die chronische Schwefelkohlenstoffvergiftung durch wiederholtes längeres Einatmen äußert sich in Kopfschmerzen, Schlaflosigkeit, Gedächtnis-, Seh- und Hörstörungen, Nervenentzündungen und Gefäßschäden.<ref name="Karlheinz Lohs, Ursula Stephan">{{Literatur| Autor=Karlheinz Lohs, Ursula Stephan | Titel=Fachlexikon Toxikologie | Verlag=Springer-Verlag | ISBN=978-3-540-27337-0 | Jahr=2008 | Online={{Google Buch | BuchID=HOsmBAAAQBAJ | Seite=401 }} | Seiten=401 }}</ref><ref name="Harald Taeger">{{Literatur| Autor=Harald Taeger | Titel=Die Klinik der entschädigungspflichtigen Berufskrankheiten | Verlag=Springer-Verlag | ISBN=978-3-642-94515-1 | Jahr=2013 | Online={{Google Buch | BuchID=UCShBgAAQBAJ | Seite=221 }} | Seiten=221 }}</ref> |
||
== Verwendung und Reaktionen == |
== Verwendung und Reaktionen == |
||
Version vom 5. Mai 2016, 16:25 Uhr
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||||
| Name | Kohlenstoffdisulfid | ||||||||
| Andere Namen |
| ||||||||
| Summenformel | CS2 | ||||||||
| Kurzbeschreibung |
farblose, stark lichtbrechende Flüssigkeit, die im Reinzustand angenehm aromatisch, auf Grund von Verunreinigung jedoch meist unangenehm riecht[1] | ||||||||
| Externe Identifikatoren/Datenbanken | |||||||||
| |||||||||
| Eigenschaften | |||||||||
| Molare Masse | 76,14 g·mol−1 | ||||||||
| Aggregatzustand |
flüssig | ||||||||
| Dichte |
1,26 g·cm−3[2] | ||||||||
| Schmelzpunkt | |||||||||
| Siedepunkt |
46,3 °C[2] | ||||||||
| Dampfdruck | |||||||||
| Löslichkeit |
| ||||||||
| Brechungsindex |
1,6319 (20 °C)[3] | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| MAK | |||||||||
| Toxikologische Daten | |||||||||
| Thermodynamische Eigenschaften | |||||||||
| ΔHf0 |
89,0 kJ/mol[7] | ||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||
Kohlenstoffdisulfid (Trivialname: Schwefelkohlenstoff, CS2) ist ein Sulfid des Kohlenstoffs.
Geschichte
Kohlenstoffdisulfid wurde 1796 von Wilhelm August Lampadius entdeckt.[8] Im letzten Viertel des 19. Jahrhunderts gab es mehrere erfolglose Versuche, Kohlenstoffdisulfid als Arbeitsflüssigkeit für Dampfmaschinen einzusetzen.[9] Schwefelkohlenstoff wurde auf Grund seiner hohen Toxizität auch zur Vernichtung von Ratten[10] und Wühlmäusen[11] eingesetzt. Die toxische Wirkung wurde 1866 beschrieben.[12]
Wegen seiner guten Lösungsmitteleigenschaften wurde Schwefelkohlenstoff z.B. als Lösemittel für weißen Phosphor in Phosphorbomben oder bei der Vulkanisation von Kautschuk nach dem Kaltvulkanisationsverfahren verwendet. Dieses Verfahren wurde jedoch durch die Heißvulkanisation verdrängt.[13]

Die Bodeninjektion mit Schwefelkohlenstoff war eine wirksame, arbeitsaufwändige und teure Methode zur Bekämpfung der Reblaus. Man brachte den flüssigen, leicht verdunstenden, giftigen Schwefelkohlenstoff mit Handinjektoren in den Hauptwurzelbereich von befallenen Rebstöcken. Durch die Veredlung der Edelsorte mit einer widerstandsfähigen Unterlagsrebe wurde diese Möglichkeit überflüssig und ist seit 1997 verboten.[1]
Gewinnung und Darstellung
Kohlenstoffdisulfid besitzt eine positive Standardbildungsenthalpie (für flüssiges CS2: ΔHf = +89,7 kJ/mol), die Synthese aus den Elementen ist damit eine endotherme Reaktion. Beim Zerfall in die Elemente Schwefel und Kohlenstoff kann die Verbindung den entsprechenden Energiebetrag wieder abgeben. Der Zerfall erfolgt jedoch nicht spontan, da es sich um eine metastabile Verbindung handelt. Die Synthese aus den Elementen erfolgte bis in die 1950er Jahre unter Luftausschluss durch Überleitung von Schwefeldämpfen über glühende Holzkohle bei 800–1000 °C.[13] Heutzutage wird Kohlenstoffdisulfid aus meist ungereinigtem Erdgas (oder anderen Quellen für Alkane) und Schwefel bei 600 °C in Gegenwart von Katalysatoren synthetisiert. Bei dieser Reaktion entsteht außerdem Schwefelwasserstoff, der industriell weiterverarbeitet wird.
Oftmals entsteht Schwefelkohlenstoff auch auf natürliche Art und Weise, zum Beispiel bei Fäulnisprozessen oder bei geologischen Prozessen.[14] Global gesehen hat Kohlenstoffdisulfid jedoch nur einen geringen Anteil an der gesamten Schwefelemission in die Atmosphäre.[15]
Eigenschaften
Kohlenstoffdisulfid ist eine farblose, stark lichtbrechende und äußerst leicht entzündliche Flüssigkeit. Der Flammpunkt liegt bei −30 °C, die Zündtemperatur beträgt 95 °C, womit sich Dämpfe bereits an mäßig heißen Oberflächen entzünden können.[1] In reinem Zustand riecht Schwefelkohlenstoff angenehm wie Ether; durch Verunreinigungen ist dieser etherische Geruch meist nicht mehr wahrnehmbar. Meist sind geringe Mengen von Schwefelverbindungen die Ursache für einen teilweise widerlichen Geruch.[16]
CS2 verbrennt mit einer sehr niedrigen Temperatur (Flammentemperatur unter 200 °C).
Die Verbindung ist ein gutes Lösungsmittel unter anderem für Iod, Schwefel, Selen, weißen Phosphor, Fette, Kautschuk und Harze. Außerdem ist es ein ausgezeichnetes Dielektrikum (Dielektrizitätskonstante εr = 2,632[17]).[13]
Toxikologie
Da Schwefelkohlenstoff gut fettlöslich ist, wird es über Lunge und Haut leicht aufgenommen. Eine längere Exposition führt zu Vergiftungserscheinungen: Die akute Schwefelkohlenstoffvergiftung äußert sich in Gesichtsrötung, euphorischen Erregungszuständen, dann Bewusstlosigkeit, Koma und Atemlähmung; die chronische Schwefelkohlenstoffvergiftung durch wiederholtes längeres Einatmen äußert sich in Kopfschmerzen, Schlaflosigkeit, Gedächtnis-, Seh- und Hörstörungen, Nervenentzündungen und Gefäßschäden.[18][19]
Verwendung und Reaktionen
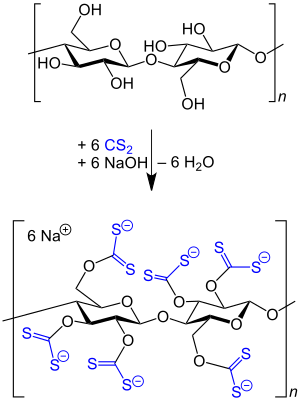
Schwefelkohlenstoff wird in großen Mengen zur Herstellung von Cellulosefasern aus Zellstoff eingesetzt, wobei der Zellstoff zuerst mit Natronlauge zu Alkalicellulose umgesetzt und diese nach dem oxidativen Abbau mit Schwefelkohlenstoff zu dem in Natronlauge löslichen Xanthogenat verarbeitet wird. Die so entstandene Celluloselösung, auch Viskose genannt, wird in schwefelsauren Spinnbädern zu Regeneratcellulose versponnen.[20][21][22]
Schwefelkohlenstoff ist ein Lösungsmittel für Fette, Harze, Gummi und Kautschuk.[23] Es wird in der Infrarot-Spektroskopie eingesetzt, da es keine störende Wasserstoff- oder Halogenbanden hat.[22] Außerdem zeigt Schwefelkohlenstoff einen starken Kerr-Effekt[24] und wird daher als Kerrlinse in Festkörperlasern eingesetzt.[25]
Kupferxanthogenate geben unter Zersetzung giftigen Schwefelkohlenstoff frei und was früher zur Schädlingsbekämpfung eingesetzt wurde.[22]
Die Reduktion mit Natrium in Dimethylformamid ergibt das Dinatriumsalz von DMIT, Kurzbezeichnung für Dimercaptoisotrithion, einer Ausgangsverbindung zur Herstellung schwefelreicher Heterocyclen und von substituierten Tetrathiafulvalenen.[26]
Beim Kochen mit wässrigen Sulfid-Lösungen entstehen Trithiocarbonate. Bei der Reaktion mit Grignard-Verbindungen entstehen durch eine Insertionsreaktion Magnesiumsalze, deren Hydrolyse Dithiocarbonsäuren (R–CSSH) ergibt. Mit Ammoniak, primären und sekundären Aminen entstehen Dithiocarbamate.[27]
Spuren von Schwefelkohlenstoff (ca. 1 mg/l) werden dem Elektrolytbad bei der galvanischen Silberabscheidung als Glanzbildner hinzugegeben. Es verursacht einen sofortigen, vorübergehenden Abfall der kathodischen Polarisation. Dadurch ist es möglich, nahezu spiegelglänzende Silberschichten abzuscheiden.[28] Diese Wirkung als sogenannter Glanzbildner ist bereits seit Mitte des 19. Jahrhunderts bekannt.[29]
Kohlenstoffdisulfid hat den gleichen Brechungsindex wie Glas, daher ist in Kohlenstoffdisulfid eingetauchtes Glas praktisch unsichtbar. Dies wird beispielsweise zum Erkennen von gefälschten Diamanten verwendet. Echte Diamanten bleiben, anders als Glas, auch beim Eintauchen gut sichtbar.
Nachweis
Kohlenstoffdisulfid gibt mit Diethylamin in Gegenwart von Kupfersalzen (Cu2+) einen gelben Dithiocarbamat-Komplex[27][30]:
Andere Nachweiseverfahren wie die Bildung von roten Kristallen durch Reaktion mit Triethylphosphin sind ebenfalls bekannt.[31]
Siehe auch
Einzelnachweise
- ↑ a b c d e Eintrag zu Schwefelkohlenstoffe. In: Römpp Online. Georg Thieme Verlag
- ↑ a b c d e Datenblatt Kohlenstoffdisulfid bei Alfa Aesar (Seite nicht mehr abrufbar).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-88.
- ↑ Datenblatt Carbon disulfide bei Sigma-Aldrich (PDF).
- ↑ Eintrag zu CAS-Nr. 75-15-0 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- ↑ Richard Dietrich: Lampadius, Wilhelm August. In: Neue Deutsche Biographie (NDB). Band 13, Duncker & Humblot, Berlin 1982, ISBN 3-428-00194-X, S. 456 f. (Digitalisat).
- ↑ The Museum of RetroTechnology: Carbon Disulphide Engines.
- ↑ Ratten. In: Meyers Großes Konversations-Lexikon. 6. Auflage. Band 16: Plaketten–Rinteln. Bibliographisches Institut, Leipzig / Wien 1908, S. 620 (zeno.org).
- ↑ Wühlmaus. In: Meyers Großes Konversations-Lexikon. 6. Auflage. Band 20: Veda–Zz. Bibliographisches Institut, Leipzig / Wien 1909, S. 763–764 (zeno.org).
- ↑ S. Cloëz: Ueber die giftigen Eigenschaften des Schwefelkohlenstoffs und über die Anwendung dieser Flüssigkeit zur Vertilgung der Ratten und der in der Erde lebenden schädlichen Thiere. In: Polytechnisches Journal. 182, 1866, S. 185.
- ↑ a b c Friedrich Warnecke: Die gewerbliche Schwefelkohlenstoffvergiftung. In: Archiv für Gewerbepathologie und Gewerbehygiene. Band 11, Nr. 2, Dezember 1941, S. 198, doi:10.1007/bf02122927 (PDF).
- ↑ Peter Fabian: Atmosphäre und Umwelt Chemische Prozesse - Menschliche Eingriffe - Ozon-Schicht - Luftverschmutzung Smog - Saurer Regen. Springer-Verlag, 2013, ISBN 978-3-662-00599-6, S. 68 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Alan R. Wellburn: Luftverschmutzung und Klimaänderung Auswirkungen auf Flora, Fauna und Mensch. Springer-Verlag, 2013, ISBN 978-3-642-59037-5, S. 104 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Fachlexikon Chemie, Harry Deutsch Verlag, Frankfurt am Main, 1979.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Permittivity (Dielectric Constant) of Liquids, S. 6-150.
- ↑ Karlheinz Lohs, Ursula Stephan: Fachlexikon Toxikologie. Springer-Verlag, 2008, ISBN 978-3-540-27337-0, S. 401 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Harald Taeger: Die Klinik der entschädigungspflichtigen Berufskrankheiten. Springer-Verlag, 2013, ISBN 978-3-642-94515-1, S. 221 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 652, ISBN 3-342-00280-8.
- ↑ Umweltbundesamt: Kohlenstoffdisulfid Stand: 03/2003, abgerufen am 5. Mai 2016
- ↑ a b c Hermann Sicius: Kohlenstoffgruppe: Elemente der vierten Hauptgruppe Eine Reise durch das Periodensystem. Springer-Verlag, 2015, ISBN 978-3-658-11166-3, S. 16 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Müfit Bahadir, Harun Parlar, Michael Spiteller: Springer Umweltlexikon. Springer-Verlag, 2013, ISBN 978-3-642-97335-2, S. 926 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. J. Chenoweth, O. L. Gaddy, D. F. Holshouser: Carbon Disulfide Traveling-Wave Kerr Cells. In: Applied Optics. 5, 1966, S. 1652, doi:10.1364/AO.5.001652.
- ↑ N. G. Basov: High-Power Lasers and Laser Plasmas / Moshchnye Lazery I Lazernaya Plazma / Мощные Лазеры И Лазерная Плазма. Springer Science & Business Media, 2012, ISBN 978-1-4684-1632-9, S. 36 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dissertation: Synthesen von Tetrathiafulvalen(TTF)-Kohlenhydratderivaten und deren Aktivitäten im MTT-Test, Angelica Heinrich, 2003, urn:nbn:de:bsz:21-opus-10112 abgerufen am 5. Mai 2016
- ↑ a b Arnold F. Holleman, Egon Wiberg: Lehrbuch der anorganischen Chemie. de Gruyter, 1995, ISBN 978-3-11-012641-9, S. 872 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Neuzeitliche galvanische Metallabscheidung, 1953, Carl Hanser Verlag München.
- ↑ Pierer's Universal-Lexikon, Band 18. Altenburg 1864, S. 517–519.
- ↑ F. Feigl, K. Weisselberg: Beiträge zum Nachweis vort Schwefelkohlenstoff. In: Zeitschrift für Analytische Chemie. 83, 1931, S. 93, doi:10.1007/BF01361030.
- ↑ F.K. Beilstein: Handbuch der organischen Chemie. Рипол Классик, 1928, ISBN 978-5-88502-336-8, S. 880 (eingeschränkte Vorschau in der Google-Buchsuche).




![{\displaystyle \mathrm {[Cu^{II}{(SC(S)N(C_{2}H_{5})_{2})}_{2}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/b00dc6fe859aaf920aed65edfff42c495a44da4b)