„Phasendiagramm“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Link eingefügt. |
Artikel mit Unterabschnitt "Mischungslücken" erweitert. |
||
| Zeile 23: | Zeile 23: | ||
=== Projektion in die Druck-Volumen-Ebene === |
=== Projektion in die Druck-Volumen-Ebene === |
||
Wird der Zustandsraum eines Reinstoffes in die Druck-Volumen-Ebene projiziert, zeigt das so erhaltene Phasendiagramm unter anderem das von Siede- und Kondensationskurve umschlossene Koexistenzgebiet von flüssiger Phase und Gasphase. Die aus Siede- und Kondensationskurve gebildete Binodale umschließt das Koexistenzgebiet von flüssiger Phase sowie Gasphase und weist am kritischen Punkt bei der kritischen Temperatur und dem kritischen Volumen ein Maximum auf. Innerhalb des Koexistenzgebietes kann die Spinodale eingezeichnet werden, die die äußeren Bereiche des Koexistenzgebietes, in denen eine homogene flüssige Phase oder eine homogene Gasphase [[Metastabilität|metastabil]] ist, vom inneren Bereich des Koexistenzgebietes, in dem eine homogene flüssige Phase oder eine homogene Gasphase instabil ist, abtrennt. Binodale und Spinodale beziehungsweise deren Projektionen in die Druck-Volumen-Ebene lassen sich aus [[Van-der-Waals-Gleichung#Isothermen im p-V-Diagramm|Van-der-Waals-Isothermen]] mit Hilfe der Maxwell-Konstruktion abschätzen.<ref name="Debenedetti" /><ref name="metastable" /> Im Verlauf von [[Isotherme Zustandsänderung|isothermen Zustandsänderunge]]<nowiki/>n bei Temperaturen unterhalb der kritischen Temperatur durchläuft der Reinstoff das Koexistenzgebiet, und es findet ein Phasenübergang erster Ordnung statt. Im Falle einer isothermen Volumenexpansion verdampft der zunächst als Flüssigkeit vorliegende Reinstoff. Im Verlauf einer isothermen Volumenkompression kondensiert der zunächst als Gas vorliegende Reinstoff. Erfolgen isotherme Zustandsänderungen oberhalb der kritischen Temperatur, findet kein Phasenübergang statt – stattdessen ändert sich die Dichte des überkritischen Fluids kontinuierlich. Anstelle von Druck-Volumen-Phasendiagrammen sind auch Druck-[[Molares Volumen|Molvolumen]]-Phasendiagramme gebräuchlich, wobei die [[Extensive Größe|extensive]] Zustandsgröße Volumen durch die [[Intensive Größe|intensive]] Zustandsgröße Molvolumen ersetzt wird. |
Wird der Zustandsraum eines Reinstoffes in die Druck-Volumen-Ebene projiziert, zeigt das so erhaltene Phasendiagramm unter anderem das von Siede- und Kondensationskurve umschlossene Koexistenzgebiet von flüssiger Phase und Gasphase. Die aus Siede- und Kondensationskurve gebildete Binodale umschließt das Koexistenzgebiet von flüssiger Phase sowie Gasphase und weist am kritischen Punkt bei der kritischen Temperatur und dem kritischen Volumen ein Maximum auf. Innerhalb des Koexistenzgebietes kann die Spinodale eingezeichnet werden, die die äußeren Bereiche des Koexistenzgebietes, in denen eine homogene flüssige Phase oder eine homogene Gasphase [[Metastabilität|metastabil]] ist, vom inneren Bereich des Koexistenzgebietes, in dem eine homogene flüssige Phase oder eine homogene Gasphase instabil ist, abtrennt. Binodale und Spinodale beziehungsweise deren Projektionen in die Druck-Volumen-Ebene lassen sich aus [[Van-der-Waals-Gleichung#Isothermen im p-V-Diagramm|Van-der-Waals-Isothermen]] mit Hilfe der Maxwell-Konstruktion abschätzen.<ref name="Debenedetti" /><ref name="metastable" /> Im Verlauf von [[Isotherme Zustandsänderung|isothermen Zustandsänderunge]]<nowiki/>n bei Temperaturen unterhalb der kritischen Temperatur durchläuft der Reinstoff das Koexistenzgebiet, und es findet ein Phasenübergang erster Ordnung statt. Im Falle einer isothermen Volumenexpansion verdampft der zunächst als Flüssigkeit vorliegende Reinstoff. Im Verlauf einer isothermen Volumenkompression kondensiert der zunächst als Gas vorliegende Reinstoff. Erfolgen isotherme Zustandsänderungen oberhalb der kritischen Temperatur, findet kein Phasenübergang statt – stattdessen ändert sich die Dichte des überkritischen Fluids kontinuierlich. Anstelle von Druck-Volumen-Phasendiagrammen sind auch Druck-[[Molares Volumen|Molvolumen]]-Phasendiagramme gebräuchlich, wobei die [[Extensive Größe|extensive]] Zustandsgröße Volumen durch die [[Intensive Größe|intensive]] Zustandsgröße Molvolumen ersetzt wird. |
||
== Gemische (Mehrkomponentensysteme) == |
== Gemische (Mehrkomponentensysteme) == |
||
| Zeile 29: | Zeile 29: | ||
Gemische können als homogene [[Mischphase|Mischphasen]] in verschiedenen Aggregatszuständen oder innerhalb einer [[Mischungslücke]] in Form koexistierender Phasen mit unterschiedlicher Zusammensetzung und/oder unterschiedlichen Aggregatzuständen vorliegen. Die Lage der Koexistenzlinien oder Koexistenzflächen im Zustandsraum eines Gemisches hängt sowohl von den Zustandsgrößen Druck, Temperatur und Volumen als auch von der Gemischzusammensetzung ab. Die Gemisch-Zusammensetzung wird durch Angabe des [[Gehaltsangabe|Gehalts]] der einzelnen Komponenten, etwa in Form des [[Massenanteil|Massenanteils]], des [[Stoffmengenanteil|Stoffmengenanteils]] oder des [[Volumenanteil|Volumenanteils]], quantifiziert. Da die Summe der Massen-, Stoffmengen- oder Volumenanteile aller Komponenten eines Gemisches gleich eins ist, ist die vollständige Zusammensetzung eines aus <math>N</math> Komponenten bestehenden Gemisches festgelegt, wenn der Gehalt von <math>N - 1</math> Komponenten angegeben wird. Daher umfasst der Zustandsraum eines aus <math>N</math> Komponenten bestehenden Gemisches <math>N + 2</math> [[Dimension (Mathematik)|Dimensionen]]. Phasendiagramme von Gemischen stellen damit Projektionen von dreidimensionalen Schnitten durch höherdimensionale Zustandsräume in eine zweidimensionale Ebene dar. |
Gemische können als homogene [[Mischphase|Mischphasen]] in verschiedenen Aggregatszuständen oder innerhalb einer [[Mischungslücke]] in Form koexistierender Phasen mit unterschiedlicher Zusammensetzung und/oder unterschiedlichen Aggregatzuständen vorliegen. Die Lage der Koexistenzlinien oder Koexistenzflächen im Zustandsraum eines Gemisches hängt sowohl von den Zustandsgrößen Druck, Temperatur und Volumen als auch von der Gemischzusammensetzung ab. Die Gemisch-Zusammensetzung wird durch Angabe des [[Gehaltsangabe|Gehalts]] der einzelnen Komponenten, etwa in Form des [[Massenanteil|Massenanteils]], des [[Stoffmengenanteil|Stoffmengenanteils]] oder des [[Volumenanteil|Volumenanteils]], quantifiziert. Da die Summe der Massen-, Stoffmengen- oder Volumenanteile aller Komponenten eines Gemisches gleich eins ist, ist die vollständige Zusammensetzung eines aus <math>N</math> Komponenten bestehenden Gemisches festgelegt, wenn der Gehalt von <math>N - 1</math> Komponenten angegeben wird. Daher umfasst der Zustandsraum eines aus <math>N</math> Komponenten bestehenden Gemisches <math>N + 2</math> [[Dimension (Mathematik)|Dimensionen]]. Phasendiagramme von Gemischen stellen damit Projektionen von dreidimensionalen Schnitten durch höherdimensionale Zustandsräume in eine zweidimensionale Ebene dar. |
||
=== Binäre Gemische === |
|||
=== Ideale binäre Mischung (Zweistoffsystem) === |
|||
==== Mischungslücken ==== |
|||
Binären Mischungen in Form von [[kondensierte Materie|kondensierter Materie]] können als homogene Mischphase stabil sein oder im Gleichgewicht innerhalb einer Mischungslücke in Form koexistierender Phasen vorliegen, wobei homogene Mischphase und koexistierende Phasen denselben Aggregatzustand aufweisen (entweder fest<ref>{{Literatur |Autor=Bruno Predel, Michael Hoch, Monte Pool |Titel=Phase Diagrams and Heterogeneous Equilibria: a Practical Introduction |Hrsg= |Sammelwerk= |Band= |Nummer= |Auflage= |Verlag=Springer-Verlag |Ort=Berlin/Heidelberg |Datum=2004 |ISBN=978-3-662-09276-7 |DOI=10.1007/978-3-662-09276-7 |Kapitel=Kapitel "3.18 Miscibility Gap in the Solid Phase" |Seiten= |Online=https://www.worldcat.org/oclc/851374554 |Abruf=2021-02-03}}</ref> oder flüssig<ref>{{Literatur |Autor=Bruno Predel, Michael Hoch, Monte Pool |Titel=Phase Diagrams and Heterogeneous Equilibria: a Practical Introduction |Hrsg= |Sammelwerk= |Band= |Nummer= |Auflage= |Verlag=Springer-Verlag |Ort=Berlin/Heidelberg |Datum=2004 |ISBN=978-3-662-09276-7 |DOI=10.1007/978-3-662-09276-7 |Kapitel=Kapitel "3.20 Miscibility Gap in the Liquid Phase" |Seiten= |Online=https://www.worldcat.org/oclc/851374554 |Abruf=2021-02-03}}</ref><ref>{{Literatur |Autor=Peter Stephan, Karlheinz Schaber, Karl Stephan, Franz Mayinger |Titel=Thermodynamik – Grundlagen und technische Anwendungen |Hrsg= |Sammelwerk= |Band=Band 2: Mehrstoffsysteme und chemische Reaktionen |Nummer= |Auflage=16 |Verlag=Springer-Verlag |Ort=Berlin/Heidelberg |Datum=2017 |ISBN=978-3-662-54438-9 |DOI=10.1007/978-3-662-54439-6 |Kapitel=Kapitel "4.2 Gleichgewicht flüssiger Phasen binärer Gemische" |Seiten= |Online=http://link.springer.com/10.1007/978-3-662-54439-6 |Abruf=2021-02-03}}</ref>), sich aber jeweils in ihrer stofflichen Zusammensetzung unterscheiden. Diejenigen Gleichgewichtszustände, in denen koexistierende Phasen stabil sind, bilden Mischungslücken, die jeweils eine Binodale von den Zuständen trennt, in denen eine homogene Mischphase stabil ist. Wird das binäre Gemisch durch eine Zustandsänderung, etwa durch eine Änderung von Druck, Temperatur, Volumen oder stofflicher Zusammensetzung, aus dem Einphasengebiet in eine Mischungslücke überführt, kommt es zu [[Entmischung (Thermodynamik)|Entmischung]]. Umgekehrt bildet sich aus koexistierenden Phasen eine homogene Mischphase, wenn das binäre Gemisch aus einer Mischungslücke in das Einphasengebiet überführt wird. Mischungslücken werden häufig in Temperatur-Zusammensetzungs-Phasendiagrammen dargestellt. Die Zusammensetzung als diejenige Zustandsgröße, in der sich innerhalb der Mischungslücke die koexistierenden Phasen unterscheiden, wird entlang der x-Achse, und die Temperatur als diejenge Zustandsgröße, die in miteinander im Gleichgewicht stehenden koexistierenden Phasen denselben Wert haben muss, entlang der y-Achse eines zweidimensionalen kartesischen Koordinatensystems aufgetragen. Im Phasendiagramm werden mindestens die Binodalen eingetragen, wobei Minima der Binodalen kritische Punkte bei einer unteren [[Kritische Lösungstemperatur|kritischen Lösungstemperatur]] und Maxima der Binodalen kritische Punkte bei einer oberen kritischen Lösungstemperatur darstellen. Weiterhin können Spinodalen in den Phasendiagrammen eingezeichnet werden. Die Spinodalen trennen innerhalb von Mischungslücken Bereiche, in denen eine homogene Mischphase metastabil ist, von Bereichen, in denen eine homogene Mischphase instabil ist, ab. |
|||
==== Änderung von Aggregatszuständen ==== |
|||
[[Datei:Phasendiagramm Gold-Aluminium.svg|mini|Phasendiagramm [[Gold|Au]]-[[Aluminium|Al]], als Beispiel für ein Zweistoffsystem: rechts 100 % Gold, links 100 % Aluminium]] |
[[Datei:Phasendiagramm Gold-Aluminium.svg|mini|Phasendiagramm [[Gold|Au]]-[[Aluminium|Al]], als Beispiel für ein Zweistoffsystem: rechts 100 % Gold, links 100 % Aluminium]] |
||
Im Fall einer idealen Mischung hat die Mischungslücke immer eine Linsenform. Charakteristika für ideales Verhalten sind das Fehlen einer Volumen- und Temperaturänderung beim Mischungsvorgang. Das Mischungsdiagramm (Schmelzdiagramm) von Forsterit (<math>\mathrm{Mg_2[SiO_4]}</math>) und Fayalit (<math>\mathrm{Fe_2[SiO_4]}</math>) stellt ein Beispiel hierfür dar, wobei dieses die Zusammensetzung von [[Olivin]] beschreibt. |
Im Fall einer idealen Mischung hat die Mischungslücke immer eine Linsenform. Charakteristika für ideales Verhalten sind das Fehlen einer Volumen- und Temperaturänderung beim Mischungsvorgang. Das Mischungsdiagramm (Schmelzdiagramm) von Forsterit (<math>\mathrm{Mg_2[SiO_4]}</math>) und Fayalit (<math>\mathrm{Fe_2[SiO_4]}</math>) stellt ein Beispiel hierfür dar, wobei dieses die Zusammensetzung von [[Olivin]] beschreibt. |
||
| Zeile 35: | Zeile 39: | ||
Am linken Rand eines solchen Diagramms liegt die erste Komponente (A) als reiner Stoff vor, und demzufolge am rechten Rand die zweite Komponente (B) ebenfalls, weshalb man auch hier eine näherungsweise vertikale Begrenzung (''Segregationslinie'') einzeichnet, um zu verdeutlichen, dass die [[Abszisse]] nach beiden Seiten begrenzt ist. Die entstehenden Kurven, die sich am linken und rechten Rand in einem Punkt treffen, beschreiben folglich die Abhängigkeit der Phasenübergangstemperaturen von der Zusammensetzung der Mischphase, wobei die Randpunkte die jeweilige Übergangstemperatur der Reinstoffe darstellen. Die Übergangstemperaturen sind bei Reinstoffen definitionsgemäß unabhängig von der Richtung der Phasenänderung, was die Außenpunkte erklärt. Treten die Stoffe jedoch in einer Mischung auf, so unterscheiden sich die Übergangswerte, je nachdem ob der Stoff verdampft oder kondensiert bzw. erstarrt oder schmilzt. Da alle drei Aggregatzustände nur im Tripelpunkt ein gemeinsames Gleichgewicht bilden, unterscheidet man die T-x-Diagramme nach den zwei auftretenden Aggregatzuständen, wobei der Übergang fest-gasförmig aufgrund der geringen Relevanz hier nicht angeführt wird. |
Am linken Rand eines solchen Diagramms liegt die erste Komponente (A) als reiner Stoff vor, und demzufolge am rechten Rand die zweite Komponente (B) ebenfalls, weshalb man auch hier eine näherungsweise vertikale Begrenzung (''Segregationslinie'') einzeichnet, um zu verdeutlichen, dass die [[Abszisse]] nach beiden Seiten begrenzt ist. Die entstehenden Kurven, die sich am linken und rechten Rand in einem Punkt treffen, beschreiben folglich die Abhängigkeit der Phasenübergangstemperaturen von der Zusammensetzung der Mischphase, wobei die Randpunkte die jeweilige Übergangstemperatur der Reinstoffe darstellen. Die Übergangstemperaturen sind bei Reinstoffen definitionsgemäß unabhängig von der Richtung der Phasenänderung, was die Außenpunkte erklärt. Treten die Stoffe jedoch in einer Mischung auf, so unterscheiden sich die Übergangswerte, je nachdem ob der Stoff verdampft oder kondensiert bzw. erstarrt oder schmilzt. Da alle drei Aggregatzustände nur im Tripelpunkt ein gemeinsames Gleichgewicht bilden, unterscheidet man die T-x-Diagramme nach den zwei auftretenden Aggregatzuständen, wobei der Übergang fest-gasförmig aufgrund der geringen Relevanz hier nicht angeführt wird. |
||
'''Schmelzdiagramm (fest-flüssig)''': |
|||
Die Grenzlinie, die den flüssigen Bereich abgrenzt, wird als ''[[Liquiduslinie]]'' bezeichnet und jene, die den festen Bereich abgrenzt, als ''[[Soliduslinie]]''. Oberhalb der Liquiduslinie ist die Substanz komplett [[flüssig]] (Abkürzung: L), unterhalb der Soliduslinie ist sie komplett [[fest]] (Abkürzung: <math>\alpha</math>). Der Bereich zwischen Liquidus- und Soliduslinie wird als Mischungslücke bezeichnet (Abkürzung: <math>\alpha + L</math>). |
Die Grenzlinie, die den flüssigen Bereich abgrenzt, wird als ''[[Liquiduslinie]]'' bezeichnet und jene, die den festen Bereich abgrenzt, als ''[[Soliduslinie]]''. Oberhalb der Liquiduslinie ist die Substanz komplett [[flüssig]] (Abkürzung: L), unterhalb der Soliduslinie ist sie komplett [[fest]] (Abkürzung: <math>\alpha</math>). Der Bereich zwischen Liquidus- und Soliduslinie wird als Mischungslücke bezeichnet (Abkürzung: <math>\alpha + L</math>). |
||
| Zeile 44: | Zeile 48: | ||
Kühlt man die Schmelze ab, verfestigt sich ein Teil der Substanz in einem bestimmten, temperaturabhängigen Verhältnis. Dieses Verhältnis kann man mit Hilfe der [[Konode]] bestimmen. Tatsächlich existiert in der Mischungs''lücke'' keine thermodynamisch stabile Zusammensetzung der beiden Substanzen, die der „Eintrittszusammensetzung“ entsprechen würde. Bei der Abkühlung wandern die thermodynamisch stabilen Zusammensetzungen von Schmelze und fester Phase entlang der [[Isotherm]]e. Die Zusammensetzung der Schmelze bewegt sich entlang der Liquiduslinie nach unten, während die Zusammensetzung der festen Phase sich mit der Soliduslinie parallel ebenfalls nach unten bewegt. Beide verbleiben dabei immer in derselben Isotherme, liegen also im T-x-Diagramm waagerecht gegenüber. Beim Aufschmelzen der festen Phase gilt das gleiche, nur dass die Zusammensetzungen mit der steigenden Temperatur im Diagramm nach oben wandern. Die hierbei durchlaufenen Temperaturen der jeweiligen Linie bezeichnet man als [[Liquidustemperatur]] bzw. [[Solidustemperatur]]. |
Kühlt man die Schmelze ab, verfestigt sich ein Teil der Substanz in einem bestimmten, temperaturabhängigen Verhältnis. Dieses Verhältnis kann man mit Hilfe der [[Konode]] bestimmen. Tatsächlich existiert in der Mischungs''lücke'' keine thermodynamisch stabile Zusammensetzung der beiden Substanzen, die der „Eintrittszusammensetzung“ entsprechen würde. Bei der Abkühlung wandern die thermodynamisch stabilen Zusammensetzungen von Schmelze und fester Phase entlang der [[Isotherm]]e. Die Zusammensetzung der Schmelze bewegt sich entlang der Liquiduslinie nach unten, während die Zusammensetzung der festen Phase sich mit der Soliduslinie parallel ebenfalls nach unten bewegt. Beide verbleiben dabei immer in derselben Isotherme, liegen also im T-x-Diagramm waagerecht gegenüber. Beim Aufschmelzen der festen Phase gilt das gleiche, nur dass die Zusammensetzungen mit der steigenden Temperatur im Diagramm nach oben wandern. Die hierbei durchlaufenen Temperaturen der jeweiligen Linie bezeichnet man als [[Liquidustemperatur]] bzw. [[Solidustemperatur]]. |
||
| ⚫ | '''Siedediagramm (flüssig-gasförmig):''' Die obere Linie im Siedediagramm stellt, im Unterschied zum Schmelzdiagramm, die Kondensationskurve (auch Taulinie genannt) dar, während die untere Linie die Siedelinie darstellt. Folglich ist die obere Phase gasförmig und die untere flüssig. Alles andere verhält sich analog zum Schmelzdiagramm. Anwendung finden die Temperatur-Molenbruch- (T-x-) bzw. Druck-Molenbruch-Diagramme (p-x-Diagramme) etwa bei der Auslegung und Berechnung einer Destillation. |
||
==== Siedediagramm (flüssig-gasförmig) ==== |
|||
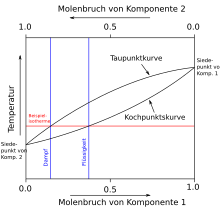
[[Datei:Binäres Siedepunktsdiagramm neu.svg|mini|Beispiel für ein T-x-Diagramm mit Siedelinse]] |
[[Datei:Binäres Siedepunktsdiagramm neu.svg|mini|Beispiel für ein T-x-Diagramm mit Siedelinse]] |
||
| ⚫ | Die obere Linie im Siedediagramm stellt, im Unterschied zum Schmelzdiagramm, die Kondensationskurve (auch Taulinie genannt) dar, während die untere Linie die Siedelinie darstellt. Folglich ist die obere Phase gasförmig und die untere flüssig. Alles andere verhält sich analog zum Schmelzdiagramm. Anwendung finden die Temperatur-Molenbruch- (T-x-) bzw. Druck-Molenbruch-Diagramme (p-x-Diagramme) etwa bei der Auslegung und Berechnung einer |
||
=== |
==== Eutektika ==== |
||
Da sich reale Mischungen oft anders verhalten als ideale Mischungen, können die Phasendiagramme nahezu beliebig vom idealisierten Bild abweichen. Phasendiagramme ''[[Eutektikum|eutektischer]]'' Zusammensetzungen weisen einen [[Eutektischer Punkt|eutektischen Punkt]] auf. Ein Beispiel dafür ist das binäre System der Minerale [[Diopsid]]-[[Anorthit]]. Weitere zum Bereich gehörende Begriffe sind ''[[Peritektikum|peritektisch]]'', ''[[Dystektikum|dystektisch]]'' und ''[[Monotektikum|monotektisch]]''. |
Da sich reale Mischungen oft anders verhalten als ideale Mischungen, können die Phasendiagramme nahezu beliebig vom idealisierten Bild abweichen. Phasendiagramme ''[[Eutektikum|eutektischer]]'' Zusammensetzungen weisen einen [[Eutektischer Punkt|eutektischen Punkt]] auf. Ein Beispiel dafür ist das binäre System der Minerale [[Diopsid]]-[[Anorthit]]. Weitere zum Bereich gehörende Begriffe sind ''[[Peritektikum|peritektisch]]'', ''[[Dystektikum|dystektisch]]'' und ''[[Monotektikum|monotektisch]]''. |
||
Besonders häufig sind nach unten (konvexe Isobare) oder seltener nach oben (konkave Isobare) unbegrenzte Mischungslücken, deren Maxima bzw. Minima man als obere bzw. untere kritische Entmischungspunkte bezeichnet. Beispiel hierfür ist eine Mischung aus Phenol und Wasser. Eine Methode zur Bestimmung der Zusammensetzung der einzelnen Phasen eines Zweikomponentensystems liefert die [[Konodenregel]]. |
Besonders häufig sind nach unten (konvexe Isobare) oder seltener nach oben (konkave Isobare) unbegrenzte Mischungslücken, deren Maxima bzw. Minima man als obere bzw. untere kritische Entmischungspunkte bezeichnet. Beispiel hierfür ist eine Mischung aus Phenol und Wasser. Eine Methode zur Bestimmung der Zusammensetzung der einzelnen Phasen eines Zweikomponentensystems liefert die [[Konodenregel]]. |
||
| ⚫ | [[Datei:Ternary Diagram Au-Bi-Te.png|mini|Ternäres Diagramm [[Gold|Au]]-[[Bismut|Bi]]-[[Tellur|Te]].<ref name="Lundin">{{Literatur |Autor=Jonas Börje Lundin |Titel=Untersuchung von bismutgebundenen Goldvererzungen bei Vetlanda, Südschweden |WerkErg= |Datum=2015 |DOI=10.13140/RG.2.1.4330.2483 |Online=https://www.researchgate.net/profile/Jonas_Lundin/publication/287206255_Untersuchung_von_bismutgebundenen_Goldvererzungen_bei_Vetlanda_Sudschweden/links/56733ad008ae04d9b099c966/Untersuchung-von-bismutgebundenen-Goldvererzungen-bei-Vetlanda-Suedschweden.pdf |Format=PDF |KBytes=9576 |Abruf=2021-02-03}}</ref> Gut erkennbar ist das dominierende Bismut, sowie die große Lücke zwischen [[Maldonit]] und Gold.]] |
||
=== Ternäre Gemische === |
=== Ternäre Gemische === |
||
| ⚫ | [[Datei:Ternary Diagram Au-Bi-Te.png|mini|Ternäres Diagramm [[Gold|Au]]-[[Bismut|Bi]]-[[Tellur|Te]].<ref name="Lundin">{{Literatur |Autor=Jonas Börje Lundin |Titel=Untersuchung von bismutgebundenen Goldvererzungen bei Vetlanda, Südschweden |WerkErg= |Datum=2015 |DOI=10.13140/RG.2.1.4330.2483 |Online=https://www.researchgate.net/profile/Jonas_Lundin/publication/287206255_Untersuchung_von_bismutgebundenen_Goldvererzungen_bei_Vetlanda_Sudschweden/links/56733ad008ae04d9b099c966/Untersuchung-von-bismutgebundenen-Goldvererzungen-bei-Vetlanda-Suedschweden.pdf |Format=PDF |KBytes=9576 |Abruf=2021-02-03}}</ref> Gut erkennbar ist das dominierende Bismut, sowie die große Lücke zwischen [[Maldonit]] und Gold.]] |
||
Phasengrenzlinien werden aus den Zustandsräumen [[Ternäres Gemisch|ternärer Gemische]] in der Regel in zweidimensionale Diagramme projiziert, die die Zusammensetzung der ternären Gemische für einen bestimmten Druck, eine bestimmte Temperatur und ein bestimmtes Volumen kartieren. Die Zusammensetzung ternärer Gemische kann im Prinzip mittels eines zweidimensionalen karthesischen Koordnatensystems, an dessen Koordinatenachsen die relativen Anteile von zwei der drei Komponenten des ternären Gemisches aufgetragen sind, in eindeutiger Weise dargestellt werden. In der Regel erfolgt die Darstellung der Zusammensetzung ternärer Gemische jedoch mit Hilfe von [[Dreiecksdiagramm|Dreiecksdiagrammen]]. Diese erlauben es, den Anteil jeder Komponente an einem ternären Gemisch jeweils an einer Koordinatenachse aufzutragen und entsprechend direkt abzulesen. An jeder Ecke eines Dreiecksdiagramms hat einer der Reinstoffe einen Anteil von 100 % am ternären Gemisch. Entspricht eine bestimmte Ecke eines Dreiecksdiagramms einem Anteil der Komponente <math>A</math> am ternären Gemisch von 100 %, verlaufen [[Isolinie|Isolinien]], die einem konstantem Anteil der Komponente <math>A</math> am ternären Gemisch von weniger als 100 % entsprechen, parallel zur gegenüberliegenden Seite des Dreiecksdiagramms. Diese verbindet wiederum die Ecken, die jeweils einem Anteil von 100 % der Komponenten <math>B</math> und <math>C</math> am ternären Gemisch entsprechen. An einer der auf die Ecke, an der Komponente <math>A</math> einen Anteil von 100 % am ternären Gemisch aufweist, zulaufenden Koordinatenachsen des Dreiecksdiagramms wird der Anteil von Komponente <math>A</math> aufgetragen. Am Schnittpunkt der Isolinien mit dieser Koordinatenachse lässt sich der Anteil von Komponente <math>A</math> am ternären Gemisch ablesen. Je größer der Abstand der Isolinie zur Ecke des Dreiecksdiagramms ist, an der das Gemisch zu 100 % Komponente <math>A</math> enthält, desto niedriger ist der Anteil der Komponente <math>A</math> am ternären Gemisch. Werden Binodalen, die Koexistenzbereiche umschließen, in ein Dreiecksdiagramm projiziert, sind die Konoden, die die auf den Binodalen lokalisierten Zustände der koexistierenen Phasen verbinden, in der Regel nicht parallel zu den Koordinatenachsen.<ref name="Predel" /><ref name="Lohrengel" /> |
Phasengrenzlinien werden aus den Zustandsräumen [[Ternäres Gemisch|ternärer Gemische]] in der Regel in zweidimensionale Diagramme projiziert, die die Zusammensetzung der ternären Gemische für einen bestimmten Druck, eine bestimmte Temperatur und ein bestimmtes Volumen kartieren. Die Zusammensetzung ternärer Gemische kann im Prinzip mittels eines zweidimensionalen karthesischen Koordnatensystems, an dessen Koordinatenachsen die relativen Anteile von zwei der drei Komponenten des ternären Gemisches aufgetragen sind, in eindeutiger Weise dargestellt werden. In der Regel erfolgt die Darstellung der Zusammensetzung ternärer Gemische jedoch mit Hilfe von [[Dreiecksdiagramm|Dreiecksdiagrammen]]. Diese erlauben es, den Anteil jeder Komponente an einem ternären Gemisch jeweils an einer Koordinatenachse aufzutragen und entsprechend direkt abzulesen. An jeder Ecke eines Dreiecksdiagramms hat einer der Reinstoffe einen Anteil von 100 % am ternären Gemisch. Entspricht eine bestimmte Ecke eines Dreiecksdiagramms einem Anteil der Komponente <math>A</math> am ternären Gemisch von 100 %, verlaufen [[Isolinie|Isolinien]], die einem konstantem Anteil der Komponente <math>A</math> am ternären Gemisch von weniger als 100 % entsprechen, parallel zur gegenüberliegenden Seite des Dreiecksdiagramms. Diese verbindet wiederum die Ecken, die jeweils einem Anteil von 100 % der Komponenten <math>B</math> und <math>C</math> am ternären Gemisch entsprechen. An einer der auf die Ecke, an der Komponente <math>A</math> einen Anteil von 100 % am ternären Gemisch aufweist, zulaufenden Koordinatenachsen des Dreiecksdiagramms wird der Anteil von Komponente <math>A</math> aufgetragen. Am Schnittpunkt der Isolinien mit dieser Koordinatenachse lässt sich der Anteil von Komponente <math>A</math> am ternären Gemisch ablesen. Je größer der Abstand der Isolinie zur Ecke des Dreiecksdiagramms ist, an der das Gemisch zu 100 % Komponente <math>A</math> enthält, desto niedriger ist der Anteil der Komponente <math>A</math> am ternären Gemisch. Werden Binodalen, die Koexistenzbereiche umschließen, in ein Dreiecksdiagramm projiziert, sind die Konoden, die die auf den Binodalen lokalisierten Zustände der koexistierenen Phasen verbinden, in der Regel nicht parallel zu den Koordinatenachsen.<ref name="Predel" /><ref name="Lohrengel" /> |
||
Version vom 3. Februar 2021, 23:12 Uhr

Ein Phasendiagramm (auch Zustandsdiagramm, Zustandsschaubild oder Gleichgewichtsschaubild) ist eine Projektion von Phasengrenzlinien aus dem Zustandsraum eines thermodynamischen Systems in ein zweidimensionales kartesisches Koordinatensystem[1] oder in ein Dreiecksdiagramm.[2][3] Neben Phasengrenzlinien können Phasendiagramme auch Spinodalen enthalten. Phasendiagramme sind ein häufig genutztes Hilfsmittel in der Chemie, den Materialwissenschaften, der Physik und der Verfahrenstechnik, um das Phasenverhalten von Reinstoffen und Stoffgemischen graphisch darzustellen.
Reinstoffe (Einkomponentensysteme)
Thermodynamische Einbettung

Die Menge aller im thermodynamischen Gleichgewicht liegenden Zustände eines Reinstoffes bildet in einem von Druck-, Temperatur- und Volumenachsen aufgespannten Zustandsraum eine Zustandsfläche, die sich in Druck-Temperatur-Volumen-Diagrammen darstellen lässt. Zustandsflächen von Reinstoffen können unter anderem folgende Merkmale enthalten:
- In den Zustandsflächen können Phasengrenzlinien liegen, bei deren Überquerung der Reinstoff Phasenübergänge durchläuft.
- Die Zustandsflächen können Koexistenzgebiete enthalten. Innerhalb der Koexistenzgebiete ist der Reinstoff in Form einer einzigen homogenen Phase instabil oder metastabil und liegt daher im thermodynamischen Gleichgewicht in Form von zumindest zwei koexistierenden Phasen vor. Phasengrenzlinien, die Koexistenzgebiete umschließen und dabei kritische Punkte als Extremwerte aufweisen, werden Binodalen genannt. Die den koexistierenden Phasen entsprechenden Zustände liegen dann auf der Binodale und werden durch Konoden verbunden. Innerhalb von Koexistenzgebieten, die durch Binodalen umschlossen werden, verlaufen Spinodalen, die an den kritischen Punkten die Binodalen berühren.[4][5]
- Zustandsflächen können weiterhin Tripellinien enthalten, an denen feste Phase, flüssige Phase sowie Gasphase koexistieren.
Neben Phasengrenzlinien, an denen die Übergänge zwischen den Aggretatszuständen gasförmig, flüssig und fest stattfinden, können Phasendiagramme von Reinstoffen Phasengrenzlinien enthalten, an denen andere Arten von Phasenübergängen stattfinden. Beispielse sind:
- Phasenübergänge zwischen kristallinen Polymorphen in der festen Phase,
- Der Phasenübergang zwischen flüssigem und suprafluidem 4He,
- Übergänge zwischen ferromagnetischem oder ferroelektrischem Verhalten zu paramagnetischem oder paraelektrischem Verhalten bei der Curie-Temperatur.
Projektion in die Druck-Temperatur-Ebene
Weist die Zustandsfläche eines Reinstoffes Koexistenzgebiete auf, müssen Temperatur und Druck der dort im Gleichgewicht stehenden koexistierenden Phasen dieselben Werte aufweisen.[6] Dies bedingt wiederum, dass die in die Druck-Temperatur-Ebene projizierten Phasengrenzlinien, die das Koexistenzgebiet begrenzen, dort aufeinander zu liegen kommen. Die Koexistenzgebiete erscheinen in der Druck-Temperatur-Ebene folglich als Linien. Phasendiagramme, die auf der Projektion des Zustandsraumes eines Reinstoffes in die Druck-Temperatur-Ebene basieren, können unter anderem folgende Elemente aufweisen:
- Der Tripelpunkt ist eine Projektion der parallel zur Volumenachse des Zustandsraums verlaufenden Tripellinie, die die Koexistenzgebiete von flüssiger Phase und Gasphase sowie von fester Phase und Gasphase voneinander trennt, in die Druck-Temperatur-Ebene.
- Die Siedekurve und die Kondensationskurve bilden eine Binodale, die das Koexistenzgebiet zwischen flüssiger Phase und Gasphase umschließt, wobei Siede- und Kondensationskurve am kritischen Punkt ineinander übergehen. Siede- und Kondensationskurve liegen in der Druck-Temperatur-Ebene genau übereinander und erscheinen dort als Dampfdruckkurve, die den Tripelpunkt und den kritischen Punkt verbindet.
- Der in der Druck-Temperatur-Ebene als Endpunkt der Dampfdruckkurve erscheinende kritische Punkt ist das Maximum der das Koexistenzgebiet aus flüssiger Phase und Gasphase umschließenden Binodalen.
- Die Sublimations- und Resublimationskurve begrenzen das Koexistenzgebiet von Feststoff und Gasphase. In der Druck-Temperatur-Ebene liegen beide Kurven aufeinander und erscheinen als Sublimationsdruckkurve, die den Nullpunkt der Druck-Temperatur-Ebene mit dem Tripelpunkt verbindet.
- Die Schmelzkurve und die Erstarrungskurve begrenzen das Koexistenzgebiet zwischen fester Phase und Flüssigkeit. In der Druck-Temperatur-Ebene liegen Schmelz- und Erstarrungskurve aufeinander und erscheinen als vom Tripelpunkt ausgehende Schmelzdruckkurve.
Projektion in die Druck-Volumen-Ebene
Wird der Zustandsraum eines Reinstoffes in die Druck-Volumen-Ebene projiziert, zeigt das so erhaltene Phasendiagramm unter anderem das von Siede- und Kondensationskurve umschlossene Koexistenzgebiet von flüssiger Phase und Gasphase. Die aus Siede- und Kondensationskurve gebildete Binodale umschließt das Koexistenzgebiet von flüssiger Phase sowie Gasphase und weist am kritischen Punkt bei der kritischen Temperatur und dem kritischen Volumen ein Maximum auf. Innerhalb des Koexistenzgebietes kann die Spinodale eingezeichnet werden, die die äußeren Bereiche des Koexistenzgebietes, in denen eine homogene flüssige Phase oder eine homogene Gasphase metastabil ist, vom inneren Bereich des Koexistenzgebietes, in dem eine homogene flüssige Phase oder eine homogene Gasphase instabil ist, abtrennt. Binodale und Spinodale beziehungsweise deren Projektionen in die Druck-Volumen-Ebene lassen sich aus Van-der-Waals-Isothermen mit Hilfe der Maxwell-Konstruktion abschätzen.[4][5] Im Verlauf von isothermen Zustandsänderungen bei Temperaturen unterhalb der kritischen Temperatur durchläuft der Reinstoff das Koexistenzgebiet, und es findet ein Phasenübergang erster Ordnung statt. Im Falle einer isothermen Volumenexpansion verdampft der zunächst als Flüssigkeit vorliegende Reinstoff. Im Verlauf einer isothermen Volumenkompression kondensiert der zunächst als Gas vorliegende Reinstoff. Erfolgen isotherme Zustandsänderungen oberhalb der kritischen Temperatur, findet kein Phasenübergang statt – stattdessen ändert sich die Dichte des überkritischen Fluids kontinuierlich. Anstelle von Druck-Volumen-Phasendiagrammen sind auch Druck-Molvolumen-Phasendiagramme gebräuchlich, wobei die extensive Zustandsgröße Volumen durch die intensive Zustandsgröße Molvolumen ersetzt wird.
Gemische (Mehrkomponentensysteme)
Thermodynamische Einbettung
Gemische können als homogene Mischphasen in verschiedenen Aggregatszuständen oder innerhalb einer Mischungslücke in Form koexistierender Phasen mit unterschiedlicher Zusammensetzung und/oder unterschiedlichen Aggregatzuständen vorliegen. Die Lage der Koexistenzlinien oder Koexistenzflächen im Zustandsraum eines Gemisches hängt sowohl von den Zustandsgrößen Druck, Temperatur und Volumen als auch von der Gemischzusammensetzung ab. Die Gemisch-Zusammensetzung wird durch Angabe des Gehalts der einzelnen Komponenten, etwa in Form des Massenanteils, des Stoffmengenanteils oder des Volumenanteils, quantifiziert. Da die Summe der Massen-, Stoffmengen- oder Volumenanteile aller Komponenten eines Gemisches gleich eins ist, ist die vollständige Zusammensetzung eines aus Komponenten bestehenden Gemisches festgelegt, wenn der Gehalt von Komponenten angegeben wird. Daher umfasst der Zustandsraum eines aus Komponenten bestehenden Gemisches Dimensionen. Phasendiagramme von Gemischen stellen damit Projektionen von dreidimensionalen Schnitten durch höherdimensionale Zustandsräume in eine zweidimensionale Ebene dar.
Binäre Gemische
Mischungslücken
Binären Mischungen in Form von kondensierter Materie können als homogene Mischphase stabil sein oder im Gleichgewicht innerhalb einer Mischungslücke in Form koexistierender Phasen vorliegen, wobei homogene Mischphase und koexistierende Phasen denselben Aggregatzustand aufweisen (entweder fest[7] oder flüssig[8][9]), sich aber jeweils in ihrer stofflichen Zusammensetzung unterscheiden. Diejenigen Gleichgewichtszustände, in denen koexistierende Phasen stabil sind, bilden Mischungslücken, die jeweils eine Binodale von den Zuständen trennt, in denen eine homogene Mischphase stabil ist. Wird das binäre Gemisch durch eine Zustandsänderung, etwa durch eine Änderung von Druck, Temperatur, Volumen oder stofflicher Zusammensetzung, aus dem Einphasengebiet in eine Mischungslücke überführt, kommt es zu Entmischung. Umgekehrt bildet sich aus koexistierenden Phasen eine homogene Mischphase, wenn das binäre Gemisch aus einer Mischungslücke in das Einphasengebiet überführt wird. Mischungslücken werden häufig in Temperatur-Zusammensetzungs-Phasendiagrammen dargestellt. Die Zusammensetzung als diejenige Zustandsgröße, in der sich innerhalb der Mischungslücke die koexistierenden Phasen unterscheiden, wird entlang der x-Achse, und die Temperatur als diejenge Zustandsgröße, die in miteinander im Gleichgewicht stehenden koexistierenden Phasen denselben Wert haben muss, entlang der y-Achse eines zweidimensionalen kartesischen Koordinatensystems aufgetragen. Im Phasendiagramm werden mindestens die Binodalen eingetragen, wobei Minima der Binodalen kritische Punkte bei einer unteren kritischen Lösungstemperatur und Maxima der Binodalen kritische Punkte bei einer oberen kritischen Lösungstemperatur darstellen. Weiterhin können Spinodalen in den Phasendiagrammen eingezeichnet werden. Die Spinodalen trennen innerhalb von Mischungslücken Bereiche, in denen eine homogene Mischphase metastabil ist, von Bereichen, in denen eine homogene Mischphase instabil ist, ab.
Änderung von Aggregatszuständen

Im Fall einer idealen Mischung hat die Mischungslücke immer eine Linsenform. Charakteristika für ideales Verhalten sind das Fehlen einer Volumen- und Temperaturänderung beim Mischungsvorgang. Das Mischungsdiagramm (Schmelzdiagramm) von Forsterit () und Fayalit () stellt ein Beispiel hierfür dar, wobei dieses die Zusammensetzung von Olivin beschreibt.
Am linken Rand eines solchen Diagramms liegt die erste Komponente (A) als reiner Stoff vor, und demzufolge am rechten Rand die zweite Komponente (B) ebenfalls, weshalb man auch hier eine näherungsweise vertikale Begrenzung (Segregationslinie) einzeichnet, um zu verdeutlichen, dass die Abszisse nach beiden Seiten begrenzt ist. Die entstehenden Kurven, die sich am linken und rechten Rand in einem Punkt treffen, beschreiben folglich die Abhängigkeit der Phasenübergangstemperaturen von der Zusammensetzung der Mischphase, wobei die Randpunkte die jeweilige Übergangstemperatur der Reinstoffe darstellen. Die Übergangstemperaturen sind bei Reinstoffen definitionsgemäß unabhängig von der Richtung der Phasenänderung, was die Außenpunkte erklärt. Treten die Stoffe jedoch in einer Mischung auf, so unterscheiden sich die Übergangswerte, je nachdem ob der Stoff verdampft oder kondensiert bzw. erstarrt oder schmilzt. Da alle drei Aggregatzustände nur im Tripelpunkt ein gemeinsames Gleichgewicht bilden, unterscheidet man die T-x-Diagramme nach den zwei auftretenden Aggregatzuständen, wobei der Übergang fest-gasförmig aufgrund der geringen Relevanz hier nicht angeführt wird.
Schmelzdiagramm (fest-flüssig): Die Grenzlinie, die den flüssigen Bereich abgrenzt, wird als Liquiduslinie bezeichnet und jene, die den festen Bereich abgrenzt, als Soliduslinie. Oberhalb der Liquiduslinie ist die Substanz komplett flüssig (Abkürzung: L), unterhalb der Soliduslinie ist sie komplett fest (Abkürzung: ). Der Bereich zwischen Liquidus- und Soliduslinie wird als Mischungslücke bezeichnet (Abkürzung: ).
Bei hohen Temperaturen hat die flüssige Phase eine im Normalfall niedrigere Gibbs-Energie () als die feste Phase; dies impliziert ein Minimum aus einer niedrigeren Enthalpie H () und/oder höheren Entropie S. Deshalb wird sie nach den Gesetzen der Thermodynamik „bevorzugt“, und die feste Phase schmilzt zugunsten der flüssigen vollständig auf. Je niedriger jedoch die Temperatur, desto besser sind die energetischen Bedingungen für die feste Phase, woraufhin die flüssige Phase zunehmend erstarrt. Es kommt dazu, dass die energetische „Oberhand“ vom Mischungsverhältnis der Stoffe abhängt, und sich folglich mehrere korrespondierende Mischphasen herausbilden. Erst wenn die Temperatur so weit sinkt, dass die feste Phase unabhängig vom Mischungsverhältnis die höhere Energie besitzt, ist die Isotherme vollständig im festen Phasenbereich des Diagramms.
Zu beachten ist, dass sich ohne eine Temperaturänderung nach einer gewissen Zeit (die in der Geologie mehrere Jahrmillionen betragen kann) ein dynamisches Gleichgewicht einstellt. Die Phasenumwandlungsprozesse gleichen sich also aus, existieren aber prinzipiell weiterhin. Besonders eindrucksvoll ist dies bei den Mischkristallen, die, wenn sie in eine Mischungslücke eintauchen, sehr langsam verschiedene Phasen ausbilden, was man als Entmischung bezeichnet.
Kühlt man die Schmelze ab, verfestigt sich ein Teil der Substanz in einem bestimmten, temperaturabhängigen Verhältnis. Dieses Verhältnis kann man mit Hilfe der Konode bestimmen. Tatsächlich existiert in der Mischungslücke keine thermodynamisch stabile Zusammensetzung der beiden Substanzen, die der „Eintrittszusammensetzung“ entsprechen würde. Bei der Abkühlung wandern die thermodynamisch stabilen Zusammensetzungen von Schmelze und fester Phase entlang der Isotherme. Die Zusammensetzung der Schmelze bewegt sich entlang der Liquiduslinie nach unten, während die Zusammensetzung der festen Phase sich mit der Soliduslinie parallel ebenfalls nach unten bewegt. Beide verbleiben dabei immer in derselben Isotherme, liegen also im T-x-Diagramm waagerecht gegenüber. Beim Aufschmelzen der festen Phase gilt das gleiche, nur dass die Zusammensetzungen mit der steigenden Temperatur im Diagramm nach oben wandern. Die hierbei durchlaufenen Temperaturen der jeweiligen Linie bezeichnet man als Liquidustemperatur bzw. Solidustemperatur.
Siedediagramm (flüssig-gasförmig): Die obere Linie im Siedediagramm stellt, im Unterschied zum Schmelzdiagramm, die Kondensationskurve (auch Taulinie genannt) dar, während die untere Linie die Siedelinie darstellt. Folglich ist die obere Phase gasförmig und die untere flüssig. Alles andere verhält sich analog zum Schmelzdiagramm. Anwendung finden die Temperatur-Molenbruch- (T-x-) bzw. Druck-Molenbruch-Diagramme (p-x-Diagramme) etwa bei der Auslegung und Berechnung einer Destillation.
Eutektika
Da sich reale Mischungen oft anders verhalten als ideale Mischungen, können die Phasendiagramme nahezu beliebig vom idealisierten Bild abweichen. Phasendiagramme eutektischer Zusammensetzungen weisen einen eutektischen Punkt auf. Ein Beispiel dafür ist das binäre System der Minerale Diopsid-Anorthit. Weitere zum Bereich gehörende Begriffe sind peritektisch, dystektisch und monotektisch. Besonders häufig sind nach unten (konvexe Isobare) oder seltener nach oben (konkave Isobare) unbegrenzte Mischungslücken, deren Maxima bzw. Minima man als obere bzw. untere kritische Entmischungspunkte bezeichnet. Beispiel hierfür ist eine Mischung aus Phenol und Wasser. Eine Methode zur Bestimmung der Zusammensetzung der einzelnen Phasen eines Zweikomponentensystems liefert die Konodenregel.

Ternäre Gemische
Phasengrenzlinien werden aus den Zustandsräumen ternärer Gemische in der Regel in zweidimensionale Diagramme projiziert, die die Zusammensetzung der ternären Gemische für einen bestimmten Druck, eine bestimmte Temperatur und ein bestimmtes Volumen kartieren. Die Zusammensetzung ternärer Gemische kann im Prinzip mittels eines zweidimensionalen karthesischen Koordnatensystems, an dessen Koordinatenachsen die relativen Anteile von zwei der drei Komponenten des ternären Gemisches aufgetragen sind, in eindeutiger Weise dargestellt werden. In der Regel erfolgt die Darstellung der Zusammensetzung ternärer Gemische jedoch mit Hilfe von Dreiecksdiagrammen. Diese erlauben es, den Anteil jeder Komponente an einem ternären Gemisch jeweils an einer Koordinatenachse aufzutragen und entsprechend direkt abzulesen. An jeder Ecke eines Dreiecksdiagramms hat einer der Reinstoffe einen Anteil von 100 % am ternären Gemisch. Entspricht eine bestimmte Ecke eines Dreiecksdiagramms einem Anteil der Komponente am ternären Gemisch von 100 %, verlaufen Isolinien, die einem konstantem Anteil der Komponente am ternären Gemisch von weniger als 100 % entsprechen, parallel zur gegenüberliegenden Seite des Dreiecksdiagramms. Diese verbindet wiederum die Ecken, die jeweils einem Anteil von 100 % der Komponenten und am ternären Gemisch entsprechen. An einer der auf die Ecke, an der Komponente einen Anteil von 100 % am ternären Gemisch aufweist, zulaufenden Koordinatenachsen des Dreiecksdiagramms wird der Anteil von Komponente aufgetragen. Am Schnittpunkt der Isolinien mit dieser Koordinatenachse lässt sich der Anteil von Komponente am ternären Gemisch ablesen. Je größer der Abstand der Isolinie zur Ecke des Dreiecksdiagramms ist, an der das Gemisch zu 100 % Komponente enthält, desto niedriger ist der Anteil der Komponente am ternären Gemisch. Werden Binodalen, die Koexistenzbereiche umschließen, in ein Dreiecksdiagramm projiziert, sind die Konoden, die die auf den Binodalen lokalisierten Zustände der koexistierenen Phasen verbinden, in der Regel nicht parallel zu den Koordinatenachsen.[2][3]
Siehe auch
- Binodale
- Entmischung (Thermodynamik)
- Konode
- p-T-Diagramm
- p-v-Diagramm
- p-V-T-Diagramm
- Phasengrenzlinie
- Phasenübergang
Weblinks
Erklärungen zu unter anderem zum kritischen Punkt, zum Tripelpunkt, zur Gibbs’schen Phasenregel und zu Zustandsdiagrammen von Wasser und Kohlenstoffdioxid:
- knapp, jedoch besonders in Bezug auf die Freiheitsgrade gut erklärt
- Mineralienatlas:Phasendiagramm
- weitere Phasendiagramme binärer Systeme
Videos zu Siede- und Schmelzdiagrammen:
- Video: Siedelinie, Taulinie und Azeotrop - Wie liest man Siedediagramme?. Jakob Günter Lauth (SciFox) 2013, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.5446/15680.
- Video: Konoden, Binodalen und invariante Punkte - Wie liest man Siedediagramme und Schmelzdiagramme?. Jakob Günter Lauth (SciFox) 2013, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.5446/15225.
Literatur
- Bruno Predel, Michael Hoch, Monte Pool: Phase Diagrams and Heterogeneous Equilibria: a Practical Introduction. Springer-Verlag, Berlin/Heidelberg 2004, ISBN 978-3-662-09276-7, doi:10.1007/978-3-662-09276-7 (worldcat.org [abgerufen am 3. Februar 2021]).
Einzelnachweise
- ↑ Klaus Stierstadt: Thermodynamik (= Springer-Lehrbuch). Springer-Verlag, Berlin/Heidelberg 2010, ISBN 978-3-642-05097-8, doi:10.1007/978-3-642-05098-5. Siehe Kapitel 9, Abbildung 9.5.
- ↑ a b Bruno Predel, Michael Hoch, Monte Pool: Phase Diagrams and Heterogeneous Equilibria: a Practical Introduction. Springer-Verlag, Berlin/Heidelberg 2004, ISBN 978-3-662-09276-7, Kapitel "4 Phase Equilibria in Three-Component Systems and Four-Component Systems with Exclusion of the Gas Phase", doi:10.1007/978-3-662-09276-7 (worldcat.org [abgerufen am 3. Februar 2021]).
- ↑ a b Burkhard Lohrengel: Thermische Trennverfahren: Trennung von Gas-, Dampf- und Flüssigkeitsgemischen. 3. Auflage. Walter de Gruyter, Berlin 2017, ISBN 978-3-11-047352-0. Siehe Kapitel "4.4.2 Teilweise Löslichkeit von Trägerstoff und Extraktionsmittel".
- ↑ a b Pablo G. Debenedetti: Metastable liquids: concepts and principles. Princeton University Press, Princeton, N.J. 1996, ISBN 0-691-08595-1, Kapitel "2.2.1 Superheated Liquids".
- ↑ a b Pierre Papon, Jacques Leblond, Paul H. E. Meijer: The physics of phase transitions: concepts and applications. 2. Auflage. Springer-Verlag, Berlin 2006, ISBN 978-3-540-33390-6, S. 132 ff. (worldcat.org [abgerufen am 2. Februar 2021]).
- ↑ Kenneth Denbigh: The Principles of Chemical Equilibrium: With Applications in Chemistry and Chemical Engineering. 4. Auflage, Cambridge University Press, Cambridge 1981, ISBN 0-521-28150-4, doi:10.1017/CBO9781139167604, S. 184.
- ↑ Bruno Predel, Michael Hoch, Monte Pool: Phase Diagrams and Heterogeneous Equilibria: a Practical Introduction. Springer-Verlag, Berlin/Heidelberg 2004, ISBN 978-3-662-09276-7, Kapitel "3.18 Miscibility Gap in the Solid Phase", doi:10.1007/978-3-662-09276-7 (worldcat.org [abgerufen am 3. Februar 2021]).
- ↑ Bruno Predel, Michael Hoch, Monte Pool: Phase Diagrams and Heterogeneous Equilibria: a Practical Introduction. Springer-Verlag, Berlin/Heidelberg 2004, ISBN 978-3-662-09276-7, Kapitel "3.20 Miscibility Gap in the Liquid Phase", doi:10.1007/978-3-662-09276-7 (worldcat.org [abgerufen am 3. Februar 2021]).
- ↑ Peter Stephan, Karlheinz Schaber, Karl Stephan, Franz Mayinger: Thermodynamik – Grundlagen und technische Anwendungen. 16. Auflage. Band 2: Mehrstoffsysteme und chemische Reaktionen. Springer-Verlag, Berlin/Heidelberg 2017, ISBN 978-3-662-54438-9, Kapitel "4.2 Gleichgewicht flüssiger Phasen binärer Gemische", doi:10.1007/978-3-662-54439-6 (springer.com [abgerufen am 3. Februar 2021]).
- ↑ Jonas Börje Lundin: Untersuchung von bismutgebundenen Goldvererzungen bei Vetlanda, Südschweden. 2015, doi:10.13140/RG.2.1.4330.2483 (researchgate.net [PDF; 9,6 MB; abgerufen am 3. Februar 2021]).



![{\displaystyle \mathrm {Mg_{2}[SiO_{4}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9e12596bba5517169be036c5736c18553ee23734)
![{\displaystyle \mathrm {Fe_{2}[SiO_{4}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1dae45b44fee788f4847fae3a68c8f71a5ba27e5)






