2-Aminopurin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Aminopurin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H5N5 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 135,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
2-Aminopurin (auch Isoadenin) ist ein Isomer der Nukleinbase Adenin. Es ist eine heterocyclische organische Verbindung mit einem Puringrundgerüst und einer Aminogruppe an Position 2.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]

|
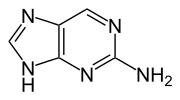
|
| Adenin, A | 2-Aminopurin (Isoadenin) |
Am ehesten paart sich 2-Aminopurin mit Thymin als Adenin-Analogon, aber auch mit Cytosin als Guanin-Analogon.[2] Es wird daher gelegentlich als experimentelles Mutagen verwendet.
Verwendung[Bearbeiten | Quelltext bearbeiten]
2-Aminopurin dient seit ca. 1990 als fluoreszierender Marker in der Nukleinsäureforschung.[3][4] Die Fluoreszenz von 2-Aminopurin (2AP) galt bis 2014 als einfach gegeben, jedoch benötigt 2AP hierfür Wasser. Auch unterscheidet sich die Fluoreszenz je nach dem Bindungsort mit Wasser. Damit sind in der Untersuchung von DNA und RNA eingesetzte 2AP-Marker nicht so zuverlässig anwendbar wie bis 2014 angenommen. Das bedingt die Überprüfung bisheriger Forschungsresultate zu Fluoreszenzproben. 2AP besitzt drei Andock-Stellen für Wasser, die das 2AP-Fluoreszenzverhalten beeinflussen: Wird ein Wassermolekül auf einer Seite des 2AP angedockt, leuchtet es bei UV-Einstrahlung schwach. An einer zweiten Stelle erhöht das Andocken die Fluoreszenz 50-fach, während an der dritten Stelle ein einziges Wassermolekül die Leuchtkraft fast verhundertfacht. Die 2AP-Nutzung als Fluoreszenzprobe steht nicht in Frage, jedoch die Interpretation der Untersuchungen. In «wasserarmer» Umgebung, in RNA-Enzymen - oder DNA-Enzym-Komplexen muss man die «starke» und «schwache» Fluoreszenz-Seite von 2AP unterscheiden. Die Umgebung von Molekülen ändert ihr Verhalten.[5]
Literatur[Bearbeiten | Quelltext bearbeiten]
- André Dallmann, Lars Dehmel, Torben Peters, Clemens Mügge, Christian Griesinger, Jennifer Tuma, Nikolaus P. Ernsting: „Der Einbau von 2-Aminopurin beeinflusst die Dynamik und Struktur von DNA“, in: Angewandte Chemie, 2010, 122 (34), S. 6126–6129 (doi:10.1002/ange.201001312).
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Datenblatt 2-Aminopurine ≥99% bei Sigma-Aldrich, abgerufen am 11. März 2011 (PDF).
- ↑ L. C. Sowers, G. V. Fazakerley, R. Eritja, B. E. Kaplan, M. F. Goodman: „Base pairing and mutagenesis: observation of a protonated base pair between 2-aminopurine and cytosine in an oligonucleotide by proton NMR“, in: Proc. Natl. Acad. Sci. USA, 1986, 83 (15), S. 5434–5438 (doi:10.1073/pnas.83.15.5434; PMC 386301 (freier Volltext); PMID 3461441).
- ↑ Marcus Menger: 2-Aminopurin als Fluoreszenzindikator zur Analyse der Struktur und Dynamik von Oligoribonukleinsäuren und Hammerhead-Ribozymen, Dissertation, Göttingen 1999 (PDF).
- ↑ J. M. Jean, K. B. Hall: „2-Aminopurine fluorescence quenching and lifetimes: role of base stacking“, in: Proc. Natl. Acad. Sci. USA, 2001, 98 (1), S. 37–41 (doi:10.1073/pnas.011442198; PMC 14540 (freier Volltext); PMID 11120885).
- ↑ Simon Lobsiger, Susan Blaser, Rajeev K. Sinha, Hans-Martin Frey, Samuel Leutwyler: „Switching on the Fluorescence of 2-Aminopurine by Site-Selective Microhydration“, in: Nature Chemistry, Oktober 2014 (doi:10.1038/nchem.2086).
