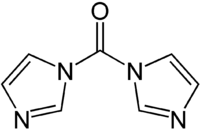
Carbonyldiimidazol
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Carbonyldiimidazol | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C7H6N4O | |||||||||
| Kurzbeschreibung |
kristalliner farbloser bis gelblicher Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 162,15 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
Zersetzung mit Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
1,1'-Carbonyldiimidazol (auch abgekürzt mit CDI) ist eine farblose kristalline organische Verbindung. Es wird unter anderem als Reagenz in der Peptidchemie und in der organischen Synthese verwendet.
Sie ist auch als Staab-Reagenz bekannt nach Heinz A. Staab, der sie in den 1950er Jahren in die organische Synthese einführte.[3][4]
Herstellung
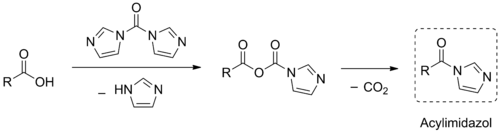
CDI wird direkt durch die Umsetzung von Phosgen mit vier Äquivalenten Imidazol unter wasserfreien Bedingungen hergestellt.[5] Nach der Entfernung des Nebenproduktes Imidazol-hydrochlorid und des Lösungsmittels wird CDI in einer Ausbeute von etwa 90 % erhalten.[6]
Bei dieser Reaktion fungiert Imidazol sowohl als Nukleophil als auch als Base. Bei der Hydrolyse von CDI entsteht wieder unter Abspaltung von Kohlenstoffdioxid das Imidazol. Durch Bestimmung der hierbei entwickelten Menge Kohlenstoffdioxid kann der Gehalt an CDI bestimmt werden.[7]
Gebrauch in der organischen Synthese
CDI wird hauptsächlich bei der Umsetzung von Alkoholen und Aminen zu den entsprechenden Harnstoff-, Carbamat- oder Ester-Derivaten benutzt.[5] CDI ist ein sicheres Syntheseequivalent von Phosgen, da dessen Giftigkeit deutlich geringer ist.
Carbonsäurederivate
CDI kann zur Aktivierung von Carbonsäuren benutzt werden. Hierbei bildet sich zuerst ein gemischtes Anhydrid, welches anschließend unter Eliminierung von Kohlenstoffdioxid in ein Acylimidazol übergeht. Diese aktivierten Spezies reagieren in Folgereaktionen wie die entsprechenden Carbonsäurehalogenide, sind jedoch um einiges leichter zu handhaben und haben so ein breiteres Anwendungsspektrum.[7]
Der Mechanismus dieser Transformation ist noch nicht abschließend aufgeklärt. Nach der Bildung des gemischten Anhydrids werden zwei Wege diskutiert: (A) Intermolekularer nucleophiler Angriff eines abgespaltenen Imidazols, gefolgt von der Eliminierung von Kohlenstoffdioxid und Imidazol[8] oder (B) Intramolekularer nucleophiler Angriff der "Anhydrid-Imidazol"-Gruppe, gefolgt von Ringöffnung und Kohlenstoffdioxid-Eliminierung.[5]
Bei der Peptidsynthese wird die so aktivierte Carbonsäure mit einer geeigneten Aminosäure oder Peptid versetzt und es wird unter Abspaltung von Kohlenstoffdioxid und Imidazol das um die entsprechende Aminosäure erweiterte Peptid erhalten.[9] Die Racemesierungsneigung der Aminosäuren ist hier aufgrund der milden Bedingungen gering.
CDI kann auch für Veresterungen verwendet werden. Da sich die CDI-Addukte von Carbonsäuren ähnlich wie Carbonsäurehalogenide verhalten, ist das Produkt der Umsetzung selbiger mit starken Nukleophilen wie Alkoholaten der entsprechende Ester. Aber auch die Reaktion mit Thiolen und Selenolen sind bekannt und führen zum entsprechenden Schwefel- bzw. Selen-Analoga eines Esters.[10] Wird ein Acetal als Nucleophil eingesetzt so erhält man das entsprechende Glycosid.[11]
Anstelle des Alkohols kann auch eine Carbonsäure als Nucleophil verwendet werden, das Produkt ist das entsprechende Anhydrid. Dabei wird am besten – wenn die Carbonsäure preiswert ist – die Carbonsäure im doppelten Überschuss eingesetzt, da hier dann das unlösliche bzw. leicht abtrennbare Salz des Imidazols als Nebenprodukt anfällt. Wird Ameisensäure als Nucleophil eingesetzt so erhält man ein potentes Formylierungs-Reagenz.
Andere Reaktionen
Bei der Reaktion mit einem Ylid wird ein Phosphonium-Salz gebildet. Diese können in einem weiteren Schritt, nach Deprotonierung, in einer Wittig-Reaktion zu einer α,β-ungesättigten Carbonylverbindung umgesetzt werden.
Die Reduktion mit Lithiumaluminiumhydrid hingegen liefert den Aldehyd und nur wenig Alkohol oder Amin. Bei der Umsetzung mit Grignard-Reagenzien erhält man in analoger Weise das Keton.[5]
Mit Acetylacetat-Anionen wird unter Bildung einer neuen Kohlenstoff-Kohlenstoff-Bindung ein substituiertes 1,3-Diketon erhalten.[12]
CDI kann als Carbonyl-Equivalent in der Synthese von Tetronsäuren oder Pulvinonen auftreten. So reagiert beispielsweise Acetol (Hydroxaceton) mit CDI unter basischen Bedingungen zur Tetronsäure.[13]
Einzelnachweise
- ↑ a b c d e Datenblatt Carbonyldiimidazol bei Merck
- ↑ a b Datenblatt Carbonyldiimidazol bei Sigma-Aldrich (PDF).
- ↑ Nachruf Heinz Staab von Thomas Carell, Francois Diederich, MPI
- ↑ Staab: Synthese, Eigenschaften und präparative Verwendung von N,N′-Carbonyl-di-imidazol, Angewandte Chemie, Band 68, 1956, S. 754
- ↑ a b c d H. A. Staab: Syntheses Using Heterocyclic Amides (Azolides). In: Angew. Chem. Int. Ed. 1962, 1, S. 351–367.
- ↑ H. A. Staab, K. Wendel: 1,1'-carbonyldiimidazole In: Organic Syntheses. 48, 1968, S. 44, doi:10.15227/orgsyn.048.0044; Coll. Vol. 5, 1973, S. 201 (PDF).
- ↑ a b A. Armstrong: N,N'-Carbonyldiimidazole. In: Encyclopedia of Reagents for Organic Synthesis 2001.
- ↑ A. El-Faham, F. Albericio: Peptide Coupling Reagents, More than a Letter Soup In: Chem. Rev. 2011, 111, S. 6557–6602; doi:10.1021/cr100048w.
- ↑ R. Paul, G. W. Anderson: N,N'-Carbonyldiimidazole, a New Peptide Forming Reagent. In: J. Am. Chem. Soc. 1960, 82, S. 4596–4600; doi:10.1021/ja01502a038.
- ↑ H.-J. Gais: Synthesis of Thiol and Selenol Esters from Carboxylic Acids and Thiols or Selenols, Respectively. In: Angew. Chem. Int. Ed. 1977, 16, S. 244–246.
- ↑ M.J. Ford, S.V. Ley: A Simple, One-Pot, Glycosidation Procedure via (1-Imidazolylcaronyl) Glycosides and Zinc Bromide. In: Synlett 1990, S. 255–256.
- ↑ D.W. Brooks, et al: "C-Acylation under Virtually Neutral Conditions". In Angew. Chem. Int. Ed. 18, 1979 S. 72–74.
- ↑ P.J. Jerris, et al.: "A Facile Synthesis of Simple Tetronic Acids And Pulvinones".In Tetrahedron Lett. 47, 1979 S. 4517–4520.