Chlorfluorid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
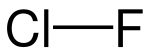
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Chlorfluorid | |||||||||||||||
| Andere Namen |
Chlormonofluorid | |||||||||||||||
| Summenformel | ClF | |||||||||||||||
| Kurzbeschreibung |
farbloses Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 54,451 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−101,1 °C[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−50 kJ/mol (Gas)[5] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Chlorfluorid ist eine Interhalogenverbindung, die aus den Elementen Chlor und Fluor besteht. Wie die meisten Interhalogene und alle Chlorfluoride ist sie extrem reaktiv.[6] Entdeckt wurde sie 1928 von Otto Ruff.[1]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Chlorfluorid kann hergestellt werden, indem man ein Gemisch von elementaren Chlor und Fluor in Anwesenheit von Kupferspänen auf 250 °C erhitzt.[1]
Ebenfalls möglich ist die Darstellung durch Reaktion von Chlortrifluorid mit Chlor.[7]
Eigenschaften und Verwendung[Bearbeiten | Quelltext bearbeiten]
Als Feststoff und Gas ist Chlorfluorid farblos, als Flüssigkeit besitzt es eine fahlgelbe Farbe. Mit Wasser, Metallen und vielen organischen Verbindungen reagiert es stürmisch unter Feuererscheinung; Glas greift es unter Bildung explosiver Chloroxide an.[8] Chlorfluorid kann als mittelstarkes Fluorierungsreagens eingesetzt werden.[3]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 466.
- ↑ a b c Mary Lide, David R. Lide: CRC Handbook of Chemistry and Physics. 87. Ausgabe, CRC Press, 1998, ISBN 978-0-84930594-8, S. 4–58.
- ↑ a b J. E. Macintyre, F. M. Daniel, V. M. Stirling: Dictionary of inorganic compounds. CRC Press, 1992, ISBN 978-0-41230120-9, S. 2829.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Erwin Riedel, Christoph Janiak: Anorganische Chemie. 9. Auflage. Walter de Gruyter GmbH, Berlin 2015, ISBN 978-3-11-035526-0, S. 431.
- ↑ Eintrag zu Chlorfluoride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Mai 2014.
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 166.
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Chlorfluoride im Lexikon der Chemie; abgerufen am 4. Juni 2009.

