Cyclododecanol
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cyclododecanol | |||||||||||||||
| Summenformel | C12H24O | |||||||||||||||
| Kurzbeschreibung |
weißer kristalliner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 184,32 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (0,04 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Cyclododecanol ist ein sekundärer macrocyclischer Alkohol mit ausgeprägt campherartigem Geruch,[3] aus dem moschusartig und holzig riechende Geruchsstoffe synthetisiert werden können.[4]
Herstellung[Bearbeiten | Quelltext bearbeiten]
Cyclododecanol (CDOL) ist ein Zwischenprodukt bei der großtechnischen Synthese von Cyclododecanon bzw. 1,12-Dodecandisäure und fällt als Bestandteil des sogenannten Ol-On-Gemischs an.[5]
Ausgehend von dem aus 1,3-Butadien zugänglichen 1,5,9-Cyclododecatrien (CDT) wird durch vollständige katalytische Hydrierung in Gegenwart von Raney-Nickel bei 200 °C und 10–15 bar Druck praktisch quantitativ das makrocyclische Alkan Cyclododecan (CDAN) erhalten.
CDAN wird – ähnlich wie bei der Umsetzung von Cyclohexan zu Cyclohexanol – mit Luft oder Sauerstoff in Gegenwart von Borsäure bei 150–160 °C und Normaldruck in flüssiger Phase oxidiert[6] (Bashkirov-Oxidation[5]). Dabei reagiert das intermediär gebildete Cyclododecanhydroperoxid mit Borsäure zum Cyclododecantriborat und wird dadurch der weiteren Oxidation zum Cyclododecanon (CDON) entzogen.
Die Hydrolyse des Triborats liefert das Ol-On-Gemisch mit einer Zusammensetzung von 80 bis 90 % CDOL und 10 bis 20 % CDON. Bei dem Produkt Cyclododecanol tel quel der Evonik Industries handelt es sich um ein Ol-On-Gemisch nicht spezifizierter Zusammensetzung.
Wegen der geringen Selektivität der Oxidationsreaktion wird der Reaktionsumsatz unter 30 % gehalten.[5]

Das Verfahren liefert relativ hohe Ausbeuten an im Vergleich zu Cyclododecan synthetisch weniger wertvollem Cyclododecanol und hat wegen des zusätzlichen Hydrolyseschritts, dem erforderlichen Recycling von Cyclododecan und der als reproduktionstoxisch zu kennzeichnenden Borsäure, sowie aufwendiger Destillationen erhebliche Nachteile.[7]
Ein Verfahren, das Borsäure vermeidet und höhere Anteile an CDON liefert, benutzt Chromoctanoat (Chrom(III)-2-ethylhexanoat) zur Zersetzung des Cyclododecylhydroperoxids, wobei Ol-On-Gemischverhältnisse bis zu 1:35 erhalten werden.[8] Allerdings ist auch diese Prozessvariante auf niedrige Umsätze (hier 10 %) beschränkt.

In einem als weniger energieintensiv beschriebenen kontinuierlichen Prozess wird CDT mit Sauerstoff bei 100 °C und ca. 790 kPa z. B. in einem Blasensäulenreaktor mit Umsätzen bis 96 % zu Monooxidationsprodukten – neben dem Hauptprodukt Epoxycyclododeca-6,10-dien entstehen CDOL und CDON – und unter optimalen Bedingungen einer Selektivität von 97 % umgesetzt.[9]
Das Reaktionsgemisch wird nach Destillation bei 220 °C und ca. 9 hPa Wasserstoffdruck über 12 Stunden mit Palladium als Katalysator mit einer Ausbeute von 97 % d.Th. zu Cyclododecanol hydriert.

Eine neuere umweltfreundlichere Alternative geht ebenfalls von CDT aus, das in Gegenwart eines langkettigen Alkylammoniumsalzes einer Heteropolysäure, hier Hexadecyltrimethylammonium-heteropolyphosphatowolframat [(n-C16H33NMe3)3PW4O16, HAHPT], mit Wasserstoffperoxid in Wasser als Lösungsmittel bei 55 °C nach einer Stunde in homogener Phase mit einer durchschnittlichen Ausbeute von 61,8 % d.Th. zu zwei isomeren Epoxycyclododecadienen [63 % 1,2-trans-Epoxy-5,9-cis, trans-cyclodecadien (I) und 37 % 1,2-cis-Epoxy-5,9-trans, trans-cyclododecadien (II)] epoxidiert wird.[10]
Der Katalysator fällt nach Verbrauch des Wasserstoffperoxids aus der Reaktionsmischung aus, behält aber seine Aktivität auch nach mehreren Reaktionszyklen.
Anschließende katalytische Hydrierung mit Raney-Nickel in Ethanol liefert CDOL in Ausbeuten bis 95%d.Th.

Nach einer weiteren Prozessvariante wird CDT zu Cyclododecen teilhydriert und dieses mit Wasser in Tetrachlormethan und dem Katalysatorsystem Chrom(III)-acetat-Essigsäure (1:3) bei 180 °C innerhalb 6h in 67%iger Ausbeute in CDOL überführt.[11]

Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Cyclododecanol ist ein farbloser kristalliner Feststoff mit ausgeprägtem Geruch nach Campher[3] und geringer Wasserlöslichkeit (40 mg/l bei 20 °C). CDOL ist in den meisten organischen Lösungsmitteln löslich, wie z. B. in Benzol, Methanol und Chloroform.[12]
Anwendungen[Bearbeiten | Quelltext bearbeiten]
Cyclododecanol wird größtenteils zu Cyclododecanon dehydriert, das Ausgangsmaterial ist für Laurinlactam, Laurinlacton und die lineare Dicarbonsäure 1,12-Dodecandisäure, sowie durch Ringerweiterung, Cyclopentadecanon und die Makrolide Cyclopentadecanolid, und Cyclohexadecanolid, die als Moschus-Geruchsstoffe Verwendung finden. Cyclododecylmethylether, Cyclododecanethyl- und -vinylether[13] und Ethoxymethoxy-cyclododecan sind Veretherungsprodukte des Cyclododecanols mit Methylchlorid oder Acetylen bzw. letzteres mit Paraformaldehyd/Chlorwasserstoff-Gas zum CDOL-chlormethylether und anschließende Williamson-Ethersynthese mit Natriumethanolat.
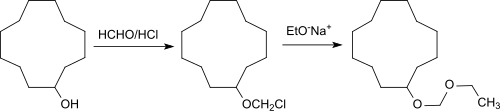
Die Ether zeichnen sich durch eine holzartige Geruchsnote aus.[4]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g Eintrag zu Cyclododecanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- ↑ Datenblatt Cyclododecanol zur Synthese bei Merck, abgerufen am 1. Oktober 2014.
- ↑ a b Evonik Industries: High Performance Building Blocks ( des vom 6. Oktober 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ a b Kurt Bauer, Dorothea Garbe, Horst Surburg: Common Fragrance and Flavor Materials: Preparation, Properties and Uses, Fourth completely revised edition. Wiley-VCH, 2001, ISBN 3-527-30364-2.
- ↑ a b c H.-J. Arpe: Industrielle Organische Chemie. 6. vollständig überarbeitete Auflage. Wiley-VCH, 2007, ISBN 978-3-527-31540-6.
- ↑ A. Chauvel, G. Lefebvre: Petrochemical Processes: 2 Major oxygenated, chlorinated and nitrated derivatives, 2nd Edition. Editions Technip, 1989, ISBN 2-7108-0563-4.
- ↑ G. Oenbrink, T. Schiffer: Ullmann’s Encyclopedia of Industrial Chemistry, 6th Edition. Cyclododecanol, Cyclododecanon and Laurolactam. Wiley-VCH, 2000, doi:10.1002/14356007.a08_201.pub2.
- ↑ Patent US5892123: Process for reproducing a mixture containing cyclododecanone and cyclododecanol. Veröffentlicht am 6. April 1999, Anmelder: E.I. du Pont de Nemours and Company, Erfinder: H. W. Anderson, J. B. Sieja.
- ↑ Patent EP2407444: Process for the preparation of dodecanedioic acid. Angemeldet am 18. März 2009, veröffentlicht am 18. Januar 2012, Anmelder: Invista Technologies S.a.r.l., Erfinder: G. Rajendran.
- ↑ Qi Feng et al.: Eco-friendly synthesis of cyclododecanone from cyclododecatriene. In: Green and Sustainable Chemistry. Band 1, Nr. 3, 2011, S. 63–69, doi:10.4236/gsc.2011.13011.
- ↑ T. M. Oshnyakova, N. A. Shchadneva, R. I. Khusnutdinov, and U. M. Dzhemilev: Addition of Water and Carbon Tetrachloride to Cyclododecene in the Presence of Chromium Catalysts. In: Russ. J. Org. Chem. Band 44, Nr. 8, 2008, S. 1240–1242, doi:10.1134/S1070428008080241.
- ↑ Datenblatt Cyclododecanol, 98+% bei Fisher Scientific , abgerufen am 1. Oktober 2014 (PDF).
- ↑ Patent EP0359117A2: Cycloalkylvinylether, deren Herstellung und Verwendung. Angemeldet am 7. September 1989, veröffentlicht am 21. März 1990, Anmelder: BASF AG, Erfinder: G. Lauterbach et al..
