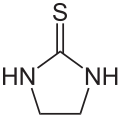
Ethylenthioharnstoff
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ethylenthioharnstoff | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3H6N2S | |||||||||||||||
| Kurzbeschreibung |
farbloser, kristalliner Feststoff mit schwach aromatischem Geruch [1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 102,16 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,4 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[5] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Ethylenthioharnstoff, abgekürzt ETU (von englisch Ethylenethiourea), ist ein handelsüblicher Vulkanisationsbeschleuniger und darüber hinaus ein toxikologisch bedeutsamer Metabolit der Fungizide aus der Gruppe der Ethylenbisdithiocarbamate (z. B. Zineb, Maneb, Metiram). Die Verbindung kann auch als Verunreinigung dieser Pflanzenschutzmittel auftreten.[3]
Herstellung[Bearbeiten | Quelltext bearbeiten]
Die Herstellung von Ethylenthioharnstoff erfolgt durch Umsetzung von Ethylendiamin (H2N–CH2–CH2–NH2) mit Schwefelkohlenstoff (CS2) zum Dithiocarbamat und anschließender Kondensationsreaktion unter Ringschluss und Abspaltung von Schwefelwasserstoff (H2S).
Anwendung[Bearbeiten | Quelltext bearbeiten]
Einzige bedeutende Anwendung ist der Einsatz als Vulkanisationsbeschleuniger für Chloropren-Kautschuk (Polychloropren). In dieser Funktion übernimmt Ethylenthioharnstoff nach klassischer Auffassung in Gegenwart von Metalloxiden wie Zinkoxid und Magnesiumoxid die Rolle eines Schwefelspenders (sulfur donor). Es wurde allerdings auch nachgewiesen, dass ETU sich bei der Vulkanisation über die Stickstoffatome an das Polychloropren bindet.[7] Im Handel ist Ethylenthioharnstoff vorzugsweise staubfrei entweder granuliert mit Öl beschichtet oder in Mischung mit Polymeren (angebatcht) zu finden, z. B. Rhenocure® NPV/C.
Toxikologie[Bearbeiten | Quelltext bearbeiten]
In pflanzlichen Lebensmitteln kann Ethylenthioharnstoff als Rückstand aus der Zersetzung der Fungizide aus der Klasse der Ethylenbisdithiocarbamate (EBDC) vorkommen. Wegen der Giftigkeit und Verdachts auf krebserzeugende Wirkung ist für ETU der Grenzwert mit 0,05 ppm entsprechend niedrig ausgewiesen (BGBI Rückstands-Höchstmengenverordnung vom 13. Januar 2003). Der analytische Nachweis nach Empfehlung des Bundesinstitut für Risikobewertung (BfR) von 2002 wird gaschromatographisch mit schwefelspezifischem Flammenphotometrischen Detektor vorgenommen.[8] Ein Nachweis mit einem Massenspektrometer ist ebenfalls möglich.
Literatur[Bearbeiten | Quelltext bearbeiten]
- R. Musch, E. Rohde and H. Casselmann: Polychloroprene Crosslinking for Improved Aging Resistance. In: Kautsch. Gummi Kunstst. 49 (1996), 340.
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Toxikologische Bewertung von Ethylenthioharnstoff (PDF) bei der Berufsgenossenschaft Rohstoffe und chemische Industrie (BG RCI), abgerufen am 1. Mai 2018.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Eintrag zu Imidazolidin-2-thion in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- ↑ a b Datenblatt Imidazolidin-2-thion bei Merck, abgerufen am 31. März 2011.
- ↑ a b c Eintrag zu Imidazolidin-2-thion. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Mai 2014.
- ↑ Eintrag zu Imidazolidine-2-thione im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 19. Oktober 2015.
- ↑ Eintrag zu Ethylene thiourea in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ Dissertation Jürgen Blanke: Modelluntersuchungen zum Einfluß von Temperatur und 2-Imidazolidinthion auf die Vernetzung von Poly(chloropren). Universität Hannover 1988.
- ↑ Bundesinstitut für Risikobewertung: Ethylenthioharnstoff (ETU) ( des vom 22. März 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 350 kB).

