Orpheovirus
| „Orpheovirus“ | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||
| Systematik | ||||||||||||||||||
| ||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||
| ||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||
| „Orpheovirus“ | ||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||
| „OBRV“ | ||||||||||||||||||
| Links | ||||||||||||||||||
|
„Orpheovirus“ ist eine vorgeschlagene Gattung von Riesenviren aus dem Phylum Nucleocytoviricota (veraltet englisch Nucleocytoplasmic large DNA viruses, NCLDV) mit der Spezies „Orpheovirus IHUMI-LCC“ alias „Orpheovirus brasiliensis“ (OBRV).[2]
Wie alle diese Riesenviren haben Orpheoviren ein Genom aus einer doppelsträngigen DNA (dsDNA). Die erste Beschreibung der Gattung wurde Anfang 2018 von J. Andrean et al. veröffentlicht. Sie konnten das Virus (Spezies „Orpheovirus IHUMI-LCC“) aus Proben von Rattenkot unter Verwendung Amöben der Spezies Vermamoeba vermiformis (Tubulinea: Euamoebida/Tubulinida) isolieren (La Ciotat, Frankreich).[3] Erste und bisher (Stand Juli 2019) einzige Spezies der Gattung ist „Orpheovirus IHUMI-LCC2“, isoliert aus einer Probe von Rattenkot in La Ciotat, Frankreich.[4][5][6]
Mit Stand April 2020 sind weder die Gattung „Orpheovirus“ noch diese Spezies vom International Committee on Taxonomy of Viruses (ICTV) registriert (Master Species List #35).[1]
Der Name ist augenscheinlich abgeleitet von Orpheus, Sänger und Dichter in der griechische Mythologie.
Aufbau[Bearbeiten | Quelltext bearbeiten]


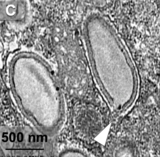
Die Viruspartikel (Virionen) sind von eiförmiger (ovoidaler) Gestalt und besitzen mindestens eine dicke Membran mit einer Öffnung (Pore, Ostiole) mit 70 bis 80 nm Durchmesser an der Spitze (Apex), ähnlich wie bei Pandoraviren (auch Cedratviren und Pithoviren). Durch diese Pore wird die DNA auf die Wirtszelle übertragen. Bei den Pandoraviren besteht die Hülle (Tegument) jedoch aus drei Schichten von jeweils etwa 20 bis 25 nm. Die Viruspartikel von „Orpheovirus“ zeigten eine dunkle dichte äußere Schicht, spärlich bedeckt mit kurzen Fibrillen. Unter dieser befindet sich ein Zwischenraum mittlerer Dichte, der nach innen begrenzt wird durch eine sehr dichte Membran (englisch hyperdense membrane). Die Länge der Virionen reicht von 900 bis 1.100 nm, einige Virionen könnten sogar bis 1.300 nm lang sein. Ihr Durchmesser beträgt etwa 500 nm.[3][6]
Genom[Bearbeiten | Quelltext bearbeiten]
„Orpheovirus IHUMI-LCC2“ besitzt ein ringförmiges Genom von 1.473.573 Basenpaaren mit einem GC-Gehalt von 25 %. Das Genom hat verschiedene Bereiche mit Wiederholungssequenzen (englisch repeats): 57 palindromische Sequenzen, sowie eine im Vergleich zu anderen Riesenviren sehr hohe Zahl von 1.527 Tandem-Repeats und 832 Kandidaten für invertierte Sequenzen (englisch inverted sequences). Mindestens 57,5 % der Gene von „Orpheovirus“ sind offene Leserahmen (englisch open reading frames, ORFs). Von 509 kodierten Proteinen gab es in 148 Fällen (12,3 %) beste Übereinstimmung mit Genen anderer Viren, in 176 Fällen mit eukaryotischen Genen (14,7 %) und in 183 Fällen(15,3 %) mit prokaryotischen Genen (von Bakterien oder Archaeen). Unter den Viren gab es beste Übereinstimmung mit „Pithovirus sibericum“, „P. massiliensis“, „Cedratvirus“ (vorgeschlagene Familie „Pithoviridae“), sowie Mimivirus und Klosneuviren (Familie Mimiviridae). Es wurden keine Gene für tRNA (Transfer-RNA) gefunden.[3]
Interessanterweise wurden Gen-Homologe mit dem Sputnik-Virophagen und dem Zamilon-Virophagen, beide Gattung Sputnikvirus, gefunden.[3]
Vermehrungszyklus[Bearbeiten | Quelltext bearbeiten]


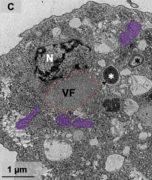
Der Eintritt der Virionen in den Wirt geschieht durch Phagocytose, wobei es den Virionen gelingt, dem darauf normalerweise folgenden phagosomalen Prozess (Verdauungsprozess) zu entkommen. Danach wird die Virus-DNA durch die ostiolartige Spitze ins Zytoplasma entlassen. Die für Riesenviren typischen Virusfabriken sind 14 bis 16 Stunden nach der Infektion gut zu erkennen. Das Bild ist in diesem frühen Stadium der Virussynthese ähnlich wie bei „Pithovirus“ und „Cedratvirus“. Die Wirtszellen sind dann 20 Stunden nach der Infektion mit neuen Virionen dicht gefüllt. Die Virionen scheinen durch Zellausbrüche (englisch bursts) oder Exocytose auszutreten und sind dann auch außerhalb der Amöbenzelle nachweisbar. Nach weiteren 4 bis 18 Stunden erfolgt vollständiger Zellausbruch.[3] Dieser relativ langsame Vermehrungszyklus ist typisch für den im Labor benutzten Wirt Vermamoeba vermiformis und wurde auch bei der Infektion dieser Spezies mit anderen Viren beobachtet, anders als wenn diese Amöben der Gattung Acanthamoeba infizieren,[3] beispielsweise bei „Faustovirus“[7] oder „Pacmanvirus“.[8] Es könnte also sein, dass sich „Orpheovirus“ in seinem natürlichen Wirt schneller vermehrt.
-
VF: Virusfabrik
-
N: Zellkern
Systematik[Bearbeiten | Quelltext bearbeiten]

Die phylogenetische Analyse des Genoms von „Orpheovirus“ zeigt eine Verwandtschaft mit der vorgeschlagenen Familie „Pithoviridae“. Einige spezifische Merkmale des Genoms zeugen jedoch von einer unterschiedlichen Entwicklung des Orpheovirus IHUMI-LCC2 im Vergleich zu „Cedratvirus“ oder „Pithovirus“ (beide putativ Pithoviridae). Die Autoren der Erstveröffentlichung (Andreani et al., 2018) schlugen daher vor, für „Orpheovirus“ eine eigene Familie „Orpheoviridae“ einzurichten, eng verwandt mit den ebenfalls bisher lediglich vorgeschlagenen „Pithoviridae“.[3][10]
Inzwischen haben Andreani et al. (2018) herausgefunden, dass ein den Rickettsiales-Bakterien zugeordneter Kandidat aus Metagenomanalysen offenbar ein „Orpheovirus“ nahe verwandtes Riesenvirus ist („Misannotatedvirus“ alias „misidentified virus“) – eine Verwechslung, wie sie auch am Anfang der Entdeckungsgeschichte des Mimivirus geschah. Außerdem fanden die Autoren noch Hinweise auf ein zweites Virus (mine drainage), dass basal in der erweiterten Familie der „Pithoviridae“ (d. h. der Gruppe der „Pithoviridae“ plus „Orpheoviridae“) steht.[5][9]
Als nächster Verwandter von „Orpheovirus“ (vertreten durch Stamm IHUMI-LCC2) gilt Sissivirus S55.[9]
Für die um diese Funde erweiterte Familie der „Pithoviridae“ schlagen Schulz et al. folgende Systematik innerhalb der NCLDV vor[11][12] – ergänzt nach Julien Andreani et al. (2018) und Clara Rolland et al. (2019):
| „Pithovirus-like viruses“[13] („Pithoviridae“[14] s. l.) |
| ||||||||||||||||||||||||||||||||||||
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Graziele Oliveira, Bernard La Scola, Jônatas Abrahão: Giant virus vs amoeba: fight for supremacy. In: Virol J, 16, 126, 4. November 2019; doi:10.1186/s12985-019-1244-3, researchgate.net (PDF)
- Khalil Geballa-Koukoulas, Bernard La Scola, Guillaume Blanc, Julien Andreani: Diversity of Giant Viruses Infecting Vermamoeba vermiformis. In: Frontiers in Microbiology, Band 13, 22. April 2022, S. 808499; doi:10.3389/fmicb.2022.808499 , PMID 35602053, PMC 9116030 (freier Volltext), PDF.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f ICTV Master Species List 2019.v1. New MSL including all taxa updates since the 2018b release, March 2020 (MSL #35). ICTV.
- ↑ Gabriel Augusto Pires de Souza, Victória Fulgêncio Queiroz, Maurício Teixeira Lima, Erik Vinicius de Sousa Reis, Luiz Felipe Leomil Coelho, Jônatas Santos Abrahão: Virus goes viral: an educational kit for virology classes. In: Virology Journal, Band 17, Nr. 13, 31. Januar 2020, doi:10.1186/s12985-020-1291-9
- ↑ a b c d e f g h i Julien Andreani, Jacques Y. B. Khalil, Emeline Baptiste, Issam Hasni, Caroline Michelle, Didier Raoult, Anthony Levasseur, Bernard La Scola: Orpheovirus IHUMI-LCC2: A New Virus among the Giant Viruses. In: Frontiers in Microbiology. Band 8, 22. Januar 2018, ISSN 1664-302X, doi:10.3389/fmicb.2017.02643.
- ↑ NCBI Taxonomy Breowser: Orpheovirus IHUMI-LCC2 (species).
- ↑ a b c d Julien Andreani, Jonathan Verneau, Didier Raoult, Anthony Levasseurn Bernard La Scola: Deciphering viral presences: two novel partial giant viruses detected in marine metagenome and in a mine drainage metagenome. In: Virology Journal, Band 15, Nr. 66, 10. April 2018, doi:10.1186/s12985-018-0976-9
- ↑ a b Khalil Geballa-Koukoulas, Bernard La Scola, Guillaume Blanc, Julien Andreani: Diversity of Giant Viruses Infecting Vermamoeba vermiformis. In: Frontiers in Microbiology, Band 13, 22. April 2022, S. 808499; doi:10.3389/fmicb.2022.808499 , PMID 35602053, PMC 9116030 (freier Volltext), PDF.
- ↑ DG Reteno, S Benamar, JB Khalil, J Andreani, N Armstrong, T Klose, M Rossmann, P Colson, D Raoult, B La Scola: Faustovirus, an asfarvirus-related new lineage of giant viruses infecting amoebae. In: J Virol., Juli 2015;89(13), S. 6585–94, PMID 25878099, PMC 4468488 (freier Volltext), doi:10.1128/JVI.00115-15
- ↑ Julien Andreani, Jacques Yaacoub Bou Khalil, Madhumati Sevvana, Samia Benamar, Fabrizio Di Pinto, Idir Bitam, Philippe Colson, Thomas Klose, Michael G. Rossmann, Didier Raoult, Bernard La Scola: Pacmanvirus, a New Giant Icosahedral Virus at the Crossroads between Asfarviridae and Faustoviruses. In: J Virol., v.91(14); 15. Juli 2017; PMID 28446673, PMC 5487549 (freier Volltext)
- ↑ a b c d e Clara Rolland, Julien Andreani, Amina Cherif Louazani, Sarah Aherfi, Rania Francis, Rodrigo Rodrigues, Ludmila Santos Silva, Dehia Sahmi, Said Mougari, Nisrine Chelkha, Meriem Bekliz, Lorena Silva, Felipe Assis, Fábio Dornas, Jacques Yaacoub Bou Khalil, Isabelle Pagnier, Christelle Desnues, Anthony Levasseur, Philippe Colson, Jônatas Abrahão, Bernard La Scola: Discovery and Further Studies on Giant Viruses at the IHU Mediterranee Infection That Modified the Perception of the Virosphere. In: Viruses, 11(4), März/April 2019, pii: E312, doi:10.3390/v11040312, PMC 6520786 (freier Volltext), PMID 30935049.
- ↑ List of the main “giant” viruses known as of today. (PDF; 334 kB) Centre national de la recherche scientifique, Université Aix Marseille, 18. April 2018
- ↑ Frederik Schulz, Lauren Alteio, Danielle Goudeau, Elizabeth M. Ryan, Feiqiao B. Yu, Rex R. Malmstrom, Jeffrey Blanchard, Tanja Woyke: Hidden diversity of soil giant viruses. In: Nature Communications, volume 9, 19. November 2018, Article number: 4881; doi:10.1038/s41467-018-07335-2
- ↑ Jan Osterkamp: Virologie: Riesenviren sind weiter verbreitet als gedacht. Spektrum.de, 20. November 2018.
- ↑ Julien Guglielmini, Anthony C. Woo, Mart Krupovic, Patrick Forterre, Morgan Gaia: Diversification of giant and large eukaryotic dsDNnA viruses predated the origin of modern eukaryotes. In: PNAS, Band 116, Nr. 39, 10./24. September 2019, S. 19585–19592, doi:10.1073/pnas.1912006116, PMID 31506349, Fig. 2
- ↑ Eugene V. Koonin, Natalya Yutin: Multiple evolutionary origins of giant viruses. In: F1000 Research, 22. November 2018, doi:10.12688/f1000research.16248.1, version 1