Pyruvatdehydrogenase-Komplex
| Übergeordnet |
|---|
| Zytosol |
| Gene Ontology |
| QuickGO |
Der Pyruvatdehydrogenase-Komplex (PDC) ist ein sehr großer Multienzymkomplex, der die irreversible oxidative Decarboxylierung von Pyruvat katalysiert. Er ist für die Energiegewinnung aus Kohlenhydraten, beispielsweise D-Glucose, essenziell nötig, da er die Glykolyse mit dem Citratzyklus verbindet.
Ein funktionierender Pyruvatdehydrogenase-Komplex wurde in jedem aeroben Eukaryot sowie aeroben Prokaryot gefunden.[1] Bei fakultativ anaeroben Bakterien ist der Komplex unter anaeroben Bedingungen inaktiv. Obligat anaerobe Bakterien wie Clostridien oder aerobe Archaeen verwenden dagegen eine Pyruvat-Ferredoxin-Oxidoreduktase.
Aufbau
[Bearbeiten | Quelltext bearbeiten]Der Komplex findet sich bei Eukaryoten in der mitochondrialen Matrix, bei Prokaryoten im Cytoplasma[2] und bei Pflanzen zusätzlich in Plastiden.[3] Er besteht aus multiplen Kopien dreier Enzym-Untereinheiten, die jede für sich eine Teilreaktion katalysieren. Die aktiven Zentren der jeweiligen Untereinheiten sind dabei eng benachbart:[4]
Der gesamte Komplex zählt in Eukaryoten zu einem der größten, bekannten Multienzymkomplexe. Er hat einen Durchmesser von ca. 500 Å und eine molare Masse von 9,5 Megadalton.[4] Die Kernstruktur, ein Dodekaeder, wird von 60 E2-Untereinheiten gebildet, die an den 20 Ecken des Dodekaeders Trimere bilden. An diese Kernstruktur sind 30 E1 Heterotetramere und 12 E3-Homodimere lokalisiert. Darüber hinaus findet sich noch ein E3-Bindeprotein, (E3BP), welches die E3-Untereinheiten an den Gesamtkomplex bindet.[5]
Bakterien haben eine etwas andere Zusammensetzung des Komplexes. Am besten ist der PDC aus Escherichia coli untersucht, was auf die Arbeiten von Lester Reed zurückgeht.[6] Der Kern des PDC von Escherichia coli ist ein kubischer Komplex aus 24 E2-Untereinheiten, wobei 8 E2-Homotrimere die Ecken des Würfels besetzen.[7] Es gibt aber auch einige Gram-negative Bakterien, deren Kernstruktur wie die bei Eukaryoten aufgebaut ist. Die Untereinheiten E1 und E3 werden als periphere Untereinheiten bezeichnet und binden jeweils als Homodimere an die PDC Kernstruktur. Lange Zeit wurde angenommen, dass 12 E1-Homodimere und 6 E3 Homodimere an den kubischen Kern aus 24 E2 Untereinheiten binden.[6] Erst die Rekonstitution des gesamten PDC aus den einzelnen Untereinheiten in vitro zeigte, dass der mit E1- und E3-Homodimeren gesättigte PDC 16 E1-Dimere und 8 E3-Dimere gebunden hat und eine Gesamtmasse von 5.6 MDa besitzt.[8]
An den enzymatischen Reaktionen von PDC sind drei Cofaktoren beteiligt: TPP (gebunden an E1), kovalent an E2 gebundenes Liponamid und an E3 gebundenes FAD.
Die Reaktion
[Bearbeiten | Quelltext bearbeiten]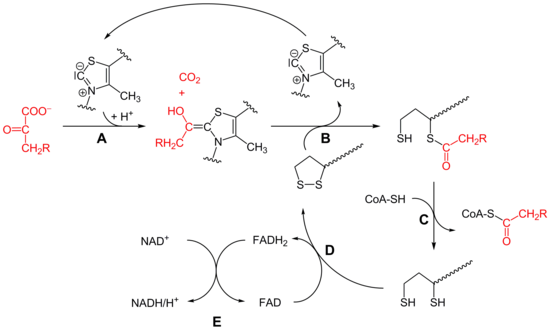
Bei der oxidativen Decarboxylierung wird vom Pyruvat (C3) Kohlenstoffdioxid (CO2) abgespalten und ein NADH gewonnen. Dabei wird eine energiereiche Thioesterbindung zwischen Coenzym A und dem Acetatrest gebildet, so dass Acetyl-CoA entsteht. Die Energie hierfür stammt aus der Decarboxylierung. Die Umwandlung von Pyruvat zu Acetyl-CoA ist unter physiologischen Bedingungen irreversibel.
Teilschritte
[Bearbeiten | Quelltext bearbeiten]- Die Decarboxylierung von Pyruvat erfolgt mit Hilfe der Pyruvatdehydrogenase (E1) des Pyruvatdehydrogenase-Komplex (A). Bei dieser katalysierten Reaktion ist Thiaminpyrophosphat (TPP) die prosthetische Gruppe und bildet eine Atombindung mit Pyruvat. Das Reaktionsprodukt ist Hydroxyethyl-TPP und CO2. Diese Hydroxyethylgruppe wird zu einer Acetylgruppe oxidiert und von Liponamid übernommen, so dass eine energiereiche Thioesterbindung, S-Acetylliponamid (B), entsteht. Liponamid ist an der Transacetylase-Untereinheit kovalent gebunden. Die Disulfidgruppe des Liponamids wird bei dieser Reaktion zur Disulfhydrylform reduziert.
- Der Acetylrest von Acetylliponamid wird auf Coenzym A übertragen, somit entstehen Acetyl-CoA und Dihydroliponamid (C). Dies wird von der Dihydrolipoyl-Transacetylase (E2) katalysiert. Formal erfolgt bei dieser Reaktion eine Umesterung, wodurch die energiereiche Thioesterbindung erhalten bleibt.[9]
- Dihydroliponamid wird durch die Dihydrolipoyl-Dehydrogenase (E3)-Untereinheit zu Liponamid regeneriert. Dabei wird ein kovalent gebundenes FAD zu FADH2 reduziert (D), welches durch die Reduktion von NAD+ wieder regeneriert wird (E). Die Übertragung von Elektronen findet normalerweise in umgekehrter Richtung von NADH zu FAD statt. Das Elektronenübertragungspotential von FAD ist durch seine chemische Umgebung innerhalb des Proteins aber ausreichend erhöht, so dass die Reaktion ablaufen kann.[9]
Somit ergibt sich folgende Gesamtreaktion:
Durch die Generierung von Acetyl-CoA aus Pyruvat wird eine Verbindung zwischen der Glykolyse und Citratzyklus hergestellt. Das entstandene Acetyl-CoA kann dann mit Oxalacetat durch die Citratsynthase weiter zu Citrat umgesetzt werden. Das NADH/H+ kann durch die Atmungskette wieder reoxidiert werden.
Essentialität von Vitamin B1 und Mangel
[Bearbeiten | Quelltext bearbeiten]Der Pyruvatdehydrogenase-Komplex ist, gemäß der beschriebenen Reaktion, für alle (Netto-)Energiegewinnung aus Kohlenhydraten (im Gegensatz zu Fetten) notwendig. Mit dem Anteil von Vitamin B1 (Thiamin) ist hierzu auch ein Vitamin nötig, also ein Stoff der von außen zugeführt werden muss. Es gibt einen erhöhten Bedarf für Thiamin bei stark erhöhter Kohlenhydratzufuhr. Bei normaler gesunder Ernährung ohne Alkoholkonsum ist eine zusätzliche Thiaminzufuhr nicht notwendig.[10][11][12][13][14]
Regulation
[Bearbeiten | Quelltext bearbeiten]Die Endprodukte Acetyl-CoA und auch NADH können zu einer Hemmung des Pyruvatdehydrogenase-Komplexes führen (Produkthemmung). Darüber hinaus wird der Komplex auch durch zwei Modifikationen reguliert. Hierbei katalysieren eine Pyruvatdehydrogenase-Kinase (PDK) und eine Phosphopyruvatdehydrogenase-Phosphatase (PDP) die reversible Phosphorylierung des cytosolischen PDC.[15] In Säugern werden drei, in Pflanzen zwei hochkonservierte Serinreste der E1-Untereinheit durch die PDK unter ATP-Verbrauch phosphoryliert. Dies bewirkt eine komplette Inaktivierung der PDC. Die Phosphatase macht die Phosphorylierung wieder rückgängig und aktiviert damit den Gesamtkomplex.
Beim Menschen wird die PDP durch Calcium- sowie Magnesiumionen stimuliert.[16] Eine Steigerung des Calciumspiegels kann auch von α-Sympathomimetika und Vasopressin hervorgerufen werden. Die PDK wird dagegen von Acetyl-CoA und NADH stimuliert, während Pyruvat, ADP und Calciumionen einen hemmenden Effekt haben. In Pflanzen ist die Aktivität der Kinase höher als die der Phosphatase, so dass sie dort noch zusätzlich reguliert werden muss. Hierbei aktiviert Ammonium (NH4+) die PDK, während Pyruvat und ADP diese hemmen.
Klinische Relevanz
[Bearbeiten | Quelltext bearbeiten]Ein Pyruvat-Dehydrogenase-Mangel (PDCD) kann durch Mutationen in einem der Enzyme oder Cofaktoren entstehen, die zum Aufbau des Komplexes verwendet werden. Der wichtigste klinische Befund ist die Laktatazidose.[17] Die PDCD-Mutationen, die nachfolgend zu einem Mangel an NAD- und FAD-Produktion führen, behindern oxidative Phosphorylierungsprozesse, welche für die aerobe Atmung von zentraler Bedeutung sind. In der Folge wird Acetyl-CoA stattdessen über anaerobe Mechanismen zu anderen Molekülen wie Laktat abgebaut, was zu einem Überschuss an körpereigenem Laktat und damit verbundenen neurologischen Pathologien führt.[18]
Ein Pyruvat-Dehydrogenase-Mangel ist zwar selten, aber es gibt eine Reihe verschiedener Gene, die, wenn sie mutiert oder nicht funktionsfähig sind, diesen Mangel verursachen können.
Erstens enthält die E1-Untereinheit der Pyruvatdehydrogenase vier verschiedene Untereinheiten: zwei α-Untereinheiten, die als E1-α bezeichnet werden, und zwei β-Untereinheiten, die als E1-β bezeichnet werden. Das PDHA1-Gen, das in den E1-α-Untereinheiten zu finden ist, verursacht, wenn es mutiert ist, 80 % der Fälle von Pyruvatdehydrogenasemangel, da diese Mutation das E1-α-Protein kürzt. Eine verminderte Funktion des E1-α-Proteins verhindert, dass die Pyruvat-Dehydrogenase ausreichend an Pyruvat bindet, wodurch die Aktivität des Gesamtkomplexes verringert wird.[19] Wenn das PDHB-Gen in der E1-β-Untereinheit des Komplexes mutiert ist, führt dies ebenfalls zu einem Pyruvat-Dehydrogenase-Mangel.[20]
Auch Mutationen in anderen Untereinheiten des Komplexes, wie das DLAT-Gen in der E2-Untereinheit, das PDHX-Gen in der E3-Untereinheit sowie eine Mutation in einem Pyruvat-Dehydrogenase-Phosphatase-Gen, bekannt als PDP1, wurden auf einen Pyruvat-Dehydrogenase-Mangel zurückgeführt, wobei ihr spezifischer Beitrag zum Krankheitszustand nicht bekannt ist.[21][22][23]
Hemmstoffe
[Bearbeiten | Quelltext bearbeiten]

Arsen(III)-verbindungen wie Arsenit (AsO33−) oder organische Arsenverbindungen gehen kovalente Verbindungen mit Sulfhydrylgruppen ein. Daher vermögen sie das Liponamid aus der PDC zu inaktivieren und wirken damit toxisch.
PDC in Plastiden
[Bearbeiten | Quelltext bearbeiten]In Pflanzen kommt der Pyruvatdehydrogenase-Komplex nicht nur in Mitochondrien vor, sondern auch in Plastiden. Dort ist er in der Bereitstellung von Acetyl-CoA für die Fettsäuresynthese involviert.[24] Jedoch ist die Aktivität des Komplexes – je nach Entwicklungsstadium der Zelle – eher gering. Der größte Teil des Acetyl-CoA wird nämlich aus Acetat bezogen, was ATP-abhängig von einer Acetyl-CoA-Synthetase katalysiert wird.
Literatur
[Bearbeiten | Quelltext bearbeiten]- ZH Zhou et al.: The remarkable structural and functional organization of the eukaryotic pyruvate dehydrogenase complexes. In: Proc Natl Acad Sci USA, 2001, 98(26), S. 14802–14807 (englisch); PMID 11752427; pnas.org (PDF).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Citratzyklus mit Stellung von Pyruvat-Dehydrogenase und Moleküldarstellungen in Farbe. In: chemistry.gsu.edu. Archiviert vom (nicht mehr online verfügbar) am 21. Februar 2014; abgerufen am 17. Januar 2016 (englisch).
- Oxidative decarboxylation of pyruvate to acetyl CoA by pyruvate dehydrogenase. reactome.org
- Eintrag zu Pyruvat-Dehydrogenase-Mangel. In: Orphanet (Datenbank für seltene Krankheiten)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Garabed Antranikian: Angewandte Mikrobiologie. Springer, Berlin 2006, ISBN 3-540-24083-7, S. 52 f.
- ↑ Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme Verlag Stuttgart 2008, ISBN 978-3-13-144861-3, S. 355.
- ↑ Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Plant Biochemistry. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5. S. 157
- ↑ a b Reginald Garrett und Charles M. Grisham: Biochemistry. (International Student Edition). Cengage Learning Services; 4. Auflage 2009; ISBN 978-0-495-11464-2; S. 566–571
- ↑ Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Plant Biochemistry. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5. S. 160
- ↑ a b Donald Voet, Judith G. Voet, Alfred Maelicke (Hrsg.), Werner Müller-Esterl (Hrsg.): Biochemie. Wiley-VCH, 1992, ISBN 3-527-28242-4, S. 185.
- ↑ ZH Zhou et al.: The remarkable structural and functional organization of the eukaryotic pyruvate dehydrogenase complexes. In: Proc Natl Acad Sci USA, 2001, 98(26), S. 14802–14807 (englisch); PMID 11752427; pnas.org (PDF).
- ↑ S Meinhold, R Zdanowicz, C Giese, R Glockshuber: Dimerization of a 5-kDa domain defines the architecture of the 5-MDa gammaproteobacterial pyruvate dehydrogenase complex. In: Sci. Adv. Band 10, Nr. 6, 2024, S. eadj6358, doi:10.1126/sciadv.adj6358, PMID 38324697, PMC 10849603 (freier Volltext) – (englisch).
- ↑ a b Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 6 Auflage. Spektrum Akademischer Verlag, Heidelberg 2007, ISBN 978-3-8274-1800-5, S. 536
- ↑ Sauberlich et al.: Thiamin requirement of the adult human. In: Am J Clin Nutr. November 1979, 32(11), S. 2237–2248. PMID 495541
- ↑ Buchseite zu Thiamin-Verbrauch aus „Ernährungsmedizin“, Thieme Verlag. books.google.de
- ↑ N Tasevska, SA Runswick, A McTaggart, SA Bingham: Twenty-four-hour urinary thiamine as a biomarker for the assessment of thiamine intake. In: Eur J Clin Nutr. Band 62, Nr. 9, September 2008, S. 1139–1147, doi:10.1038/sj.ejcn.1602829, PMID 17565356 (englisch). PMID 17565356.
- ↑ FL Iber, JP Blass, M Brin, CM Leevy: Thiamin in the elderly--relation to alcoholism and to neurological degenerative disease. In: Am. J. Clin. Nutr. Band 36, 5 Suppl, November 1982, S. 1067–1082, PMID 6765072 (englisch).
- ↑ MJ Webster, TP Scheett, MR Doyle, M Branz: The effect of a thiamin derivative on exercise performance. In: Eur J Appl Physiol Occup Physiol. Band 75, Nr. 6, 1997, S. 520–524, PMID 9202948 (englisch).
- ↑ Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Plant Biochemistry. Garland Pub, New York NY 2008, ISBN 978-0-8153-4121-5, S. 162 ff.
- ↑ Melanie Königshoff, Timo Brandenburger: Kurzlehrbuch Biochemie. Nach dem neuen GK 1. Thieme, Stuttgart 2004, ISBN 3-13-136411-4, S. 124
- ↑ Pyruvate dehydrogenase deficiency. In: ghr.nlm.nih.gov. Abgerufen am 17. März 2013.
- ↑ Neha Gupta, Chrystal Rutledge: Pyruvate Dehydrogenase Complex Deficiency: An Unusual Cause of Recurrent Lactic Acidosis in a Paediatric Critical Care Unit. In: The Journal of Critical Care Medicine. Band 5, Nr. 2, 13. Mai 2019, ISSN 2393-1817, S. 71–75, doi:10.2478/jccm-2019-0012, PMID 31161145, PMC 6534940 (freier Volltext) – (sciendo.com).
- ↑ W. Lissens, L. De Meirleir, S. Seneca, I. Liebaers, G. K. Brown, R. M. Brown, M. Ito, E. Naito, Y. Kuroda, D. S. Kerr, I. D. Wexler, M. S. Patel, B. H. Robinson, A. Seyda: Mutations in the X-linked pyruvate dehydrogenase (E1) alpha subunit gene (PDHA1) in patients with a pyruvate dehydrogenase complex deficiency. In: Human Mutation. Band 15, Nr. 3, 2000, ISSN 1059-7794, S. 209–219, doi:10.1002/(SICI)1098-1004(200003)15:3<209::AID-HUMU1>3.0.CO;2-K, PMID 10679936.
- ↑ K. Okajima, L.G. Korotchkina, C. Prasad, T. Rupar, J.A. Phillips III, C. Ficicioglu, J. Hertecant, M.S. Patel, D.S. Kerr: Mutations of the E1β subunit gene (PDHB) in four families with pyruvate dehydrogenase deficiency. In: Molecular Genetics and Metabolism. Band 93, Nr. 4, April 2008, S. 371–380, doi:10.1016/j.ymgme.2007.10.135 (elsevier.com).
- ↑ Rosemary A. Head, Ruth M. Brown, Zarazuela Zolkipli, Raveen Shahdadpuri, Mary D. King, Peter T. Clayton, Garry K. Brown: Clinical and genetic spectrum of pyruvate dehydrogenase deficiency: Dihydrolipoamide acetyltransferase (E2) deficiency. In: Annals of Neurology. Band 58, Nr. 2, August 2005, ISSN 0364-5134, S. 234–241, doi:10.1002/ana.20550 (wiley.com).
- ↑ Hana Pavlu-Pereira, Maria João Silva, Cristina Florindo, Sílvia Sequeira, Ana Cristina Ferreira, Sofia Duarte, Ana Luísa Rodrigues, Patrícia Janeiro, Anabela Oliveira, Daniel Gomes, Anabela Bandeira, Esmeralda Martins, Roseli Gomes, Sérgia Soares, Isabel Tavares de Almeida, João B. Vicente, Isabel Rivera: Pyruvate dehydrogenase complex deficiency: updating the clinical, metabolic and mutational landscapes in a cohort of Portuguese patients. In: Orphanet Journal of Rare Diseases. Band 15, Nr. 1, Dezember 2020, ISSN 1750-1172, doi:10.1186/s13023-020-01586-3, PMID 33092611, PMC 7579914 (freier Volltext) – (biomedcentral.com).
- ↑ Hye Jin Heo, Hyoung Kyu Kim, Jae Boum Youm, Sung Woo Cho, In-Sung Song, Sun Young Lee, Tae Hee Ko, Nari Kim, Kyung Soo Ko, Byoung Doo Rhee, Jin Han: Mitochondrial pyruvate dehydrogenase phosphatase 1 regulates the early differentiation of cardiomyocytes from mouse embryonic stem cells. In: Experimental & Molecular Medicine. Band 48, Nr. 8, 19. August 2016, ISSN 2092-6413, S. e254–e254, doi:10.1038/emm.2016.70, PMID 27538372, PMC 5007642 (freier Volltext) – (nature.com).
- ↑ Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3, S. 354
