sec-Butyllithium
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
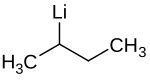
| Name | sec-Butyllithium | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H9Li | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 64,05 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Siedepunkt |
90 °C (0,05 Torr)[2] | ||||||||||||||||||
| Löslichkeit |
löslich in Cyclohexan[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
sec-Butyllithium (s-BuLi) ist eine sekundäre metallorganische Verbindung des Elements Lithium (Organolithium-Verbindung). Daneben gibt es noch die isomeren Formen n-Butyllithium und tert-Butyllithium. Die Basizität nimmt in der Reihe n-Butyllithium < sec-Butyllithium < tert-Butyllithium zu. s-BuLi ist somit die zweitstärkste Base in dieser Reihe. sec-Butyllithium ist kommerziell üblicherweise als Lösung in Cyclohexan erhältlich. Während der Lagerung kann sich ein feiner Lithiumhydrid-Niederschlag bilden; Dies führt auch zu Konzentrationserniedrigung der Lösungen.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Die Synthese kann durch Reaktion von 2-Chlorbutan mit elementarem Lithium erfolgen.[5]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]

Physikalische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
sec-Butyllithium ist eine farblose, viskose Flüssigkeit.[6] Für den Reinstoff wurde massenspektrometrisch eine Tetramerstruktur nachgewiesen.[7] In unpolaren Lösungsmitteln wie Benzol, Cyclohexan oder Cyclopentan liegt die Verbindung als Tetramer vor.[6][8][9] Bei Temperaturen von −41 °C konnte in Cyclopentan mittels 6Li-NMR-Spektroskopie ein Hexamer detektiert werden.[9] In Lösungsmitteln mit Donoreigenschaften wie Tetrahydrofuran existiert ein Gleichgewicht zwischen dimeren und monomeren Strukturen.[10]
Chemische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
s-BuLi kann für den Lithium-Halogenaustausch an halogenierten Aromaten oder zum Deprotonieren, beispielsweise von Aminen oder Alkoholen, verwendet werden. Mit Kupfer(I)-iodid werden Lithiumdi-sec-butylcuprate gebildet. Im Vergleich zu n-BuLi reagiert s-BuLi bei Raumtemperatur schneller mit Diethylether und THF. Die Verbindung zerfällt bei Raumtemperatur langsam bzw. bei erhöhter Temperatur schneller in Lithiumhydrid und einem Butengemisch aus 1-Buten, cis-2-Buten und trans-2-Buten.[11][12]
Reines s-Butyllithium ist pyrophor[1] und verbrennt an der Luft mit einer typisch roten Flamme.
Verwendung[Bearbeiten | Quelltext bearbeiten]
Die Kohlenstoff-Lithium-Bindung ist stark polarisiert, was dazu führt, dass der Kohlenstoff sehr nucleophil und basisch ist. s-Buli ist basischer als n-Buli und zusätzlich sterisch mehr gehindert. Diese beiden Eigenschaften kann man sich in diversen Synthesen zu Nutze machen. Es wird z. B. eingesetzt, wenn nur eine schwache C-H-Acidität vorliegt und n-BuLi keine zufriedenstellende Resultate liefert. Zudem wird s-Butyllithium als Katalysator für technische Polymerisationen von Isopren, Butadien und Styrol verwendet.[1]
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
s-BuLi ist an der Luft selbstentzündlich und reagiert zudem heftig mit Wasser. Das Reagenz muss daher immer unter Schutzgas (z. B. Argon) gelagert und gehandhabt werden.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Eintrag zu Butyllithium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 6. Dezember 2013.
- ↑ T. V. Ovaska: s-Butyllithium. In: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, New York 2001. doi:10.1002/047084289X.rb397.
- ↑ a b c Datenblatt sec-Butyllithium solution, 1.4 M in cyclohexane bei Sigma-Aldrich, abgerufen am 23. April 2011 (PDF).
- ↑ Teile der Gefahrstoffkennzeichnung beziehen sich auf die Gefahren, die durch das Lösungsmittel verursacht werden.
- ↑ H. Gilman, F. W. Moore, O. Baine: Secondary and Tertiary Alkyllithium Compounds and Some Interconversion Reactions with Them. In: J. Am. Chem. Soc. 63, 1941, S. 2479–2482, doi:10.1021/ja01854a046.
- ↑ a b U. Wietelmann, R. J. Bauer: Lithium and Lithium Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2005, doi:10.1002/14356007.a15_393
- ↑ D. Plavsic, D. Srzic, L. Klasinc: Mass spectrometric investigations of alkyllithium compounds in the gas phase. In: J. Phys. Chem. 90, 1986, S. 2075–2080, doi:10.1021/j100401a020.
- ↑ S. Bywater, D. J. Worsfold: Alkyllithium anionic polymerization initiators in hydrocarbon solvents. In: J. Organomet. Chem. 10, 1967, S. 1–6.
- ↑ a b G. Fraenkel, M. Henrichs, M. Hewitt, B. M. Su: Structure and dynamic behavior of a chiral alkyllithium compound: 13C and 6Li NMR of sec-butyllithium. In: J. Am. Chem. Soc. 106, 1984, S. 255–256.
- ↑ W. Bauer, W. R. Winchester, P. von Schleyer: Monomeric organolithium compounds in tetrahydrofuran: tert-butyllithium, sec-butyllithium, supermesityllithium, mesityllithium, and phenyllithium. Carbon-lithium coupling constants and the nature of carbon-lithium bonding. In: Organometallics. 6, 1987, S. 2371–2379, doi:10.1021/om00154a017.
- ↑ W. H. Glaze, J. Lin, E. G. Felton: The Thermal Decomposition of sec.-Butyllithium. In: J. Org. Chem. 30, 1965, S. 1258–1259, doi:10.1021/jo01015a514.
- ↑ W. H. Glaze, J. Lin, E. G. Felton: The Pyrolysis of Unsolvated Alkyllithium Compounds. In: J. Org. Chem. 31, 1966, S. 2643–2645, doi:10.1021/jo01346a044.
Literatur[Bearbeiten | Quelltext bearbeiten]
- Heinz G. O. Becker u. a.: Organikum. 21. Auflage. Wiley-VCH, Weinheim 2001, ISBN 3-527-29985-8.
- Christoph Elschenbroich: Organometallchemie. 5. Auflage. Teubner, Wiesbaden 2005, ISBN 3-519-53501-7.






