Strontiumnitrat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Strontiumnitrat | |||||||||||||||
| Andere Namen |
Salpetersaures Strontium | |||||||||||||||
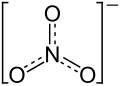
| Summenformel | Sr(NO3)2 | |||||||||||||||
| Kurzbeschreibung |
farblose Kristalle, die sich in der Hitze zersetzen[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 211,63 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
2,986 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
Zersetzung[2] | |||||||||||||||
| Löslichkeit |
gut in Wasser (660 g·l−1 bei 20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−978,2 kJ/mol[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Strontiumnitrat, Sr(NO3)2, ist das Strontiumsalz der Salpetersäure. Es wird als Oxidationsmittel in der Pyrotechnik verwendet und gibt dort die strontiumtypische tiefrote Flammenfarbe.
Herstellung[Bearbeiten | Quelltext bearbeiten]
Strontiumnitrat wird hergestellt, indem Strontiumcarbonat in Salpetersäure aufgelöst wird.[5]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Das wasserfreie Strontiumnitrat kristallisiert oberhalb von 31,3 °C, das Tetrahydrat unterhalb dieser Temperatur aus wässriger Lösung aus.[6] Wasserfreies Strontiumnitrat kristallisiert dabei im kubischen Kristallsystem in der Raumgruppe Pa3 (Raumgruppen-Nr. 205) mit dem Gitterparameter a = 778,13 pm. In der Elementarzelle befinden sich vier Formeleinheiten.[7] Die Kristalle sind isotyp zu Bariumnitrat. Das Tetrahydrat bildet monokline Kristalle mit der Raumgruppe C2/c (Nr. 15), den Gitterparametern a = 1112 pm, b = 1417 pm, c = 634 pm, β = 123,75° und vier Formeleinheiten in der Elementarzelle.[8]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Strontiumnitrat wird u. a. in der Pyrotechnik verwendet. Zusammen mit Magnesiumpulver wird bei hoher Temperatur, begünstigt durch z. B. 5-Amino-1H-tetrazol oder Hexamethylentetramin, kurzzeitig Strontium(I)-hydroxid (SrOH) erzeugt. Dieser ist ein starker Emitter im roten Spektralbereich und fungiert als alleiniger Farbgeber in lichtstarken und tiefgesättigten roten pyrotechnischen Leuchtsätzen.[9]
In Kombination mit Glycidylazid-Polymer (GAP) wird es unter dem Namen REACH-solid für den Gasgenerator des Unterwasser-Rettungssystems auf deutschen U-Booten der Klasse 212 A eingesetzt.[10][11]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Eintrag zu Strontiumnitrat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 5. Dezember 2013.
- ↑ a b c d e f g Eintrag zu Strontiumnitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Datenblatt Strontiumnitrat bei Sigma-Aldrich, abgerufen am 14. Mai 2017 (PDF).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-16.
- ↑ J.P. MacMillan, J.W. Park, R. Gerstenberg, H. Wagner, K. Köhler, P. Wallbrecht: Strontium and Strontium Compounds in Ullmanns Encyclopedia of Industrial Chemistry, 2012 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, doi:10.1002/14356007.a25_321.
- ↑ Gmelins Handbuch der Anorganischen Chemie: Strontium, System Nummer 29, Achte Auflage, Verlag Chemie GmbH, Berlin 1931, Seite 96.
- ↑ H. Nowotny, G. Heger: Structure refinement of strontium nitrate, Sr(NO3)2, and barium nitrate, Ba(NO3)2 in Acta Cryst. 1983, C39, S. 952–956 doi:10.1107/S0108270183006976
- ↑ B. Ribár, B. Matković und M. šljukić: Die Kristallstruktur von Strontiumnitrat-Tetrahydrat, Sr(NO3)2 · 4 H2O in Zeitschrift für Kristallographie 1972, 135, S. 137–144. doi:10.1524/zkri.1972.135.1-2.137
- ↑ Jesse J. Sabatini, Ernst-Christian Koch, Jay C. Poret, Jared D. Moretti, Seth M. Harbol: Rote pyrotechnische Leuchtsätze – ohne Chlor! In: Angewandte Chemie. 127, 2015, S. 11118–11120, doi:10.1002/ange.201505829.
- ↑ ANALYSIS OF ALTERNATIVES & SOCIO-ECONOMIC ANALYSIS
- ↑ Development of a Gas-Generator Propellant for a Rescue System for Submarines based on the Energetic Binder GAP


