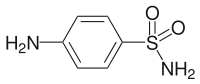
Sulfanilamid
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Freiname | Sulfanilamid | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C6H8N2O2S | ||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Arzneistoffangaben | |||||||||||||
| ATC-Code | |||||||||||||
| Wirkstoffklasse | |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 172,21 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte | |||||||||||||
| Schmelzpunkt | |||||||||||||
| pKS-Wert |
10,58 [2] | ||||||||||||
| Löslichkeit |
| ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Sulfanilamid ist ein Arzneistoff aus der Gruppe der Sulfonamide, der als Antibiotikum eingesetzt wurde.
Geschichte

Sulfanilamid wurde als erster Vertreter der Sulfonamide 1908 von Paul Gelmo synthetisiert[5], allerdings erkannte erst Gerhard Domagk mit seiner Veröffentlichung aus dem Jahre 1935 den chemotherapeutischen Nutzen der Sulfonamide (Sulfamidochrysoidin, Prontosil)[6]. Sulfanilamid wurde ab 1935 therapeutisch eingesetzt, ist aber durch andere Sulfonamide ersetzt worden.
1937 führte die Sulfanilamid-Katastrophe in den USA, bei der mehr als hundert Personen durch mit Diethylenglykol zubereitetem Sulfanilamid-Sirup zu Tode kamen, zur Verabschiedung des Federal Food, Drug and Cosmetic Act, dem Kern des Arzneimittelrechtes der Vereinigten Staaten.
Gewinnung und Darstellung
Die dreistufige Synthese der Verbindung startet mit Acetanilid, welches mit Chlorsulfonsäure umgesetzt wird. Die Zielverbindung ergibt sich dann durch Umwandlung des Säurechlorids mittels Ammoniak zum Säureamid und anschließender Verseifung des Acetamidfunktion.[4]
Chemische Eigenschaften
Sulfanilamid gehört zur Stoffgruppe der Sulfonamide. Diese bestehen aus einem Benzolkern mit einer Amino- und einer Sulfonamidgruppe. Sie alle sind schwache organische Säuren und meist schlecht löslich in Wasser (die Natriumsalze der Sulfonamide sind meist gut wasserlöslich).
Verwendung
Verwendet wird Sulfanilamid hauptsächlich als Antibiotikum. Dabei wird es bei der Folsäuresynthese anstatt para-Aminobenzoesäure in die Folsäure eingebaut, die dadurch unwirksam wird. Bei Organismen, die Folsäure über die Nahrung aufnehmen müssen, wie zum Beispiel dem Menschen, wird deswegen keine Schädigung verursacht.
Weiterhin ist es Ausgangsstoff zur Erzeugung anderer Derivate.
Sicherheitshinweise
Sulfanilamid ist ein Abbauprodukt des Herbizids Asulam (CAS 3337-71-1).
Einzelnachweise
- ↑ a b c d e f Eintrag zu Sulfanilamid in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ a b Eintrag in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b c Eintrag zu Sulfanilamid. In: Römpp Online. Georg Thieme Verlag
- ↑ a b c d A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances - Synthesis, Patents, Applications, 4. Auflage (2000), Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9
- ↑ L. F. Fieser, M. Fieser In: Lehrbuch der organischen Chemie. 3.Auflage. Verlag Chemie, Weinheim a. d. Bergstraße 1957, S. 1193.
- ↑ Domagk Beitrag zur Chemotherapie der bakteriellen Infektionen, Deutsch. Med. Wochenschrift, Band 61, 15. Februar 1935, S. 250-253, Domagk Chemotherapie der bakteriellen Infektionen, Angewandte Chemie, Band 46, 1935, S. 657-667
Weblinks
- Eintrag zu Sulfanilamid bei Vetpharm
