1,2-Dichlorethan
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 1,2-Dichlorethan (IUPAC) | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C2H4Cl2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, ölige Flüssigkeit mit chloroformartigem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 98,97 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
1,25 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
84 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (8,7 g·l−1 bei 20 °C)[1] | |||||||||||||||||||||
| Brechungsindex |
1,4422 (25 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend (CMR)[4]; zulassungspflichtig[5] | |||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Treibhauspotential |
1 (bezogen auf 100 Jahre)[7] | |||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−166,8 kJ/mol[8] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
1,2-Dichlorethan (Ethylendichlorid, EDC, früher auch Chloräther) ist eine farblose, brennbare und giftige Flüssigkeit mit chloroformartigem Geruch. Diese chemische Verbindung gehört zu den Chlorkohlenwasserstoffen.
Geschichte[Bearbeiten | Quelltext bearbeiten]
1,2-Dichlorethan wurde erstmals 1794 von den vier niederländischen Chemikern Adriaan Paets van Troostwijk, Johan Rudolph Deiman, Nicolaas Bondt und Anthonie Lauwerenburgh durch Reaktion von Ethen mit Chlor synthetisiert (Öl der holländischen Chemiker).[9][10]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Großtechnisch hergestellt wird 1,2-Dichlorethan durch Oxychlorierung von Ethen mit Chlorwasserstoff und Sauerstoff in der Gasphase bei Temperaturen von 200 – 360 °C und Drücken von 1 – 9 bar. Als Katalysator wird Kupfer(II)-chlorid verwendet, gelegentlich verwendet man auch Eisen(III)-chlorid.[11]
Der Katalysatorträger wird als Fest- oder Fließbett angeordnet und kann im Allgemeinen in jedem bekannten Reaktortyp erfolgen. Bevorzugt sind vor allem Wirbelschichtreaktoren.[11]
Ein weiteres großtechnisches Verfahren zur Herstellung von 1,2-Dichlorethan beruht auf der Direktchlorierung von Ethen. Hierfür werden ebenfalls Metallhalogenide wie Eisen(III)-chlorid als Katalysator verwendet.
Diese Reaktion verläuft mit einer spezifischen Reaktionsenthalpie von −182,6 kJ·mol−1 exotherm.[12]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Physikalische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
1,2-Dichlorethan ist eine farblose Flüssigkeit. In fester Phase treten zwei polymorphe Formen auf. Das Polymorph II wandelt sich bei −98 °C mit einer Umwandlungsenthalpie von 2,845 kJ·mol−1 in das Polymorph I um, das bei −35,55 °C mit einer Schmelzenthalpie von 8,745 kJ·mol−1 schmilzt.[13] Die Mischbarkeit mit Wasser ist sehr begrenzt. Mit steigender Temperatur steigt die Löslichkeit von 1,2-Dichlorethan in Wasser bzw. steigt die Löslichkeit von Wasser in 1,2-Dichlorethan.[14]
Löslichkeiten zwischen 1,2-Dichlorethan und Wasser[14] Temperatur °C 0 9,3 19,7 29,7 39,4 50,3 61,0 70,6 80,7 1,2-Dichlorethan in Wasser in Ma-% 0,82 0,77 0,72 0,81 0,98 1,06 1,08 1,13 1,06 Wasser in 1,2-Dichlorethan in Ma-% 0,106 0,133 0,176 0,230 0,276 0,349 0,412 0,492
Sicherheitstechnische Kenngrößen[Bearbeiten | Quelltext bearbeiten]
1,2-Dichlorethan bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 13 °C.[1][15] Der Explosionsbereich liegt zwischen 4,2 Vol.‑% (174 g/m3) als untere Explosionsgrenze (UEG) und 16 Vol.‑% (660 g/m3) als obere Explosionsgrenze (OEG).[1][1] In Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt sich ein unterer Explosionspunkt von 8 °C.[1] Die Grenzspaltweite wurde mit 1,8 mm bestimmt.[1][15] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[1][15] Die Zündtemperatur beträgt 440 °C.[1][15] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung[Bearbeiten | Quelltext bearbeiten]
Dichlorethan wird zur Herstellung von Vinylchlorid gebraucht. Es wird durch thermische Eliminierung in Vinylchlorid und Chlorwasserstoff umgewandelt. Aus 1,2-Dichlorethan wird auch 1,1,1-Trichlorethan hergestellt. Es ist ein gutes Lösungs- und Extraktionsmittel. Das 1,2-Dichlorethan wird in Abbeizmitteln, als sogenannter Scavenger in verbleiten Kraftstoffen, Lösungsmitteln für Harze (Kunstharz / Naturharz) und Asphalte und in Bitumen verwendet.
Außerdem wird es großtechnisch zur Herstellung von Ethylenaminen, speziell Ethylendiamin, durch Ammonolyse verwendet:
Zudem dient es als Lösungsmittel bei der Synthese von Polyepichlorhydrin[16].
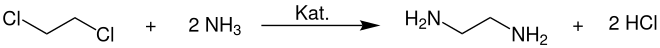
Zersetzung durch Bakterien[Bearbeiten | Quelltext bearbeiten]
Forschern der Universität Gent ist es gelungen, einen Bakterienstamm zu isolieren, der das krebserzeugende und giftige 1,2-Dichlorethan innerhalb weniger Tage restlos abbauen kann. Die Wissenschaftler entschieden sich, dem Stamm den Namen Desulfitobacterium dichloroeliminans zu geben.[17]
Sicherheitshinweise und gesetzliche Regelungen[Bearbeiten | Quelltext bearbeiten]
1,2-Dichlorethan ist hautreizend, narkotisierend, und führt zu Organschädigungen (Leber, Niere, Blut). Außerdem kann es die Früh- und Totengeburtenrate erhöhen. Es führt zu Vergiftungen beim Verschlucken. 1,2-Dichlorethan ist leichtentzündlich. Beim Verbrennen können gefährliche Gase entstehen. Bei Reaktionen mit Alkalimetallen kann es zu Explosionen kommen. 1,2-Dichlorethan ist sehr umweltschädlich und wassergefährdend (Wassergefährdungsklasse 3).
1,2-Dichlorethan wurde im Dezember 2011 aufgrund seiner Einstufung als krebserzeugend (Carc. 1B) in die Kandidatenliste der besonders besorgniserregenden Stoffe (Substance of very high concern, SVHC) aufgenommen.[4] Im August 2014 wurde 1,2-Dichlorethan danach in das Verzeichnis der zulassungspflichtigen Stoffe mit dem Ablauftermin für die Verwendung in der EU zum 22. November 2017 aufgenommen.[5][18]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i j k l m n o p q r s Eintrag zu 1,2-Dichlorethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-154.
- ↑ Eintrag zu 1,2-dichloroethane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 17. Juli 2014.
- ↑ a b Eintrag im Verzeichnis der zulassungspflichtigen Stoffe der Europäischen Chemikalienagentur, abgerufen am 17. Juli 2014.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 107-06-2 bzw. 1,2-Dichlorethan), abgerufen am 14. September 2019.
- ↑ G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (ipcc.ch [PDF; 15,5 MB]).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- ↑ Eintrag zu Dichlorethane. In: Römpp Online. Georg Thieme Verlag, abgerufen am 8. Juni 2014.
- ↑ Vgl. auch den Begriff oil of the olefiant gas bei Justus Liebig. Siehe dazu Albert Faulconer, Thomas Edward Keys: Chloroform. In: Foundations of Anesthesiology. 2 Bände, Charles C Thomas, Springfield (Illinois) 1965, Band 1, S. 442–481, hier: S. 455.
- ↑ a b Patentanmeldung WO2008155394A2: Verfahren zur Herstellung von 1,2-Dichlorethan. Angemeldet am 19. Juni 2008, veröffentlicht am 24. Dezember 2008, Anmelder: BASF SE, Erfinder: Heiko Urtel, Henrik Junicke, Rupert Wagner, Volker Schuda.
- ↑ Conn, J.B.; Kistiakowsky, G.B.; Smith, E.A.: Heats of organic reactions. VII. Addition of halogens to olefins in J. Am. Chem. Soc. 60 (1938) 2764–2771.
- ↑ Railing, W.E.: The specific heat of some ethylene halides in J. Am. Chem. Soc. 61 (1939) 3349–3353.
- ↑ a b R. M. Stephenson: Mutual Solubilities: Water-Ketones, Water-Ethers, and Water-Gasoline-Alcohols in J. Chem. Eng. Data 37 (1992) 80–95, doi:10.1021/je00005a024.
- ↑ a b c d E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen - Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- ↑ ANALYSIS OF ALTERNATIVES & SOCIO-ECONOMIC ANALYSIS
- ↑ Ann Maes, Hilde Van Raemdonck, Katherine Smith, Wendy Ossieur, Luc Lebbe, Willy Verstraete: Transport and Activity of Desulfitobacterium dichloroeliminans Strain DCA1 during Bioaugmentation of 1,2-DCA-Contaminated Groundwater. In: Environmental Science & Technology. 40, 2006, S. 5544–5552, doi:10.1021/es060953i.
- ↑ Verordnung (EU) Nr. 895/2014
- Feuergefährlicher Stoff
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 40
- Gesundheitsschädlicher Stoff bei Verschlucken
- Giftiger Stoff bei Einatmen
- Hautreizender Stoff
- Augenreizender Stoff
- Atemwegsreizender Stoff
- Krebserzeugender Stoff
- CMR-Stoff
- SVHC-Stoff
- Zulassungspflichtiger Stoff nach REACH-Anhang XIV
- Chloralkan
- Begasungsmittel
- Gefährliche Chemikalie nach dem Rotterdamer Übereinkommen
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 28




