13-Hydroperoxy-9,11,15-octadecatriensäure
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
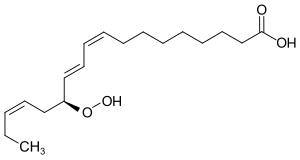
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | 13-Hydroperoxy-9,11,15-octadecatriensäure | ||||||||||||
| Andere Namen |
(9Z,11E,13S,15Z)-13-Hydroperoxy-9,11,15-octadecatriensäure (IUPAC) | ||||||||||||
| Summenformel | C18H30O4 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 310,4 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
13-Hydroperoxy-9Z,11E,15Z-octadecatriensäure (13-HPOT) ist eine konjugierte Fettsäure mit einer Hydroperoxid-Funktion und kommt natürlich als biosynthetisches Intermediat (Zwischenprodukt) vor, das durch Oxidation von Linolensäure entsteht. Ein ebenfalls vorkommendes Isomer ist die 9-Hydroperoxy-10,12,15-octadecatriensäure (9-HPOT). Auch Linolsäure bildet analoge Hydroperoxide.[2]
Vorkommen und Bedeutung
[Bearbeiten | Quelltext bearbeiten]
13-HPOT ist ein Intermediat bei verschiedenen biosynthetischen Prozessen in Pflanzen, insbesondere der Bildung von Oxylipinen.[3] Verbindungen, die so gebildet werden, sind unter anderem Hydroxy-Verbindungen, Epoxyhydroxy-Verbindungen, Aldehyde, Ketone und Divinylether.[2][3] 13-HPOT entsteht durch enzymatische Reaktionen in Pflanzen vor allem in (S)-Konfiguration.[4]
Zwei Verbindung, die eine wichtige Rolle bei der Reaktion von Pflanzen auf Verletzungen spielen und durch eine Hydroperoxid-Lyase aus 13-HPOT oder der verwandten 13-Hydroperoxy-9,11-octadecadiensäure (13-HODE) gebildet werden, sind das Traumatin und sein Folgeprodukt Traumatinsäure. Daneben entsteht außerdem (E)-2-Hexenal bzw. (Z)-3-Hexenal.[3][5][6] In Früchten von Paprika und Tomaten, sowie den Blättern von Arabidopsis thaliana, kommen Hydroperoxid-Lyasen vor, die hochselektiv für 13-HPOT sind und fast keine Aktivität gegenüber 9-HODE aufweisen. In Gurken kommen zwei Hydroperoxid-Lyasen vor, die die beiden Isomere spalten können.[6] In Zuckermelonen (Cucumis melo) kommt eine Hydroperoxid-Lyase vor, die bevorzugt 9-HODE umsetzt, aber auch - langsamer mit den anderen Hydroperoxiden der Linolsäure und Linolensäure reagiert, inklusive 13-HPOT.[7] (S)-13-HPOT ist auch ein Vorläufer der Jasmonate, die durch eine Allenoxid-Synthase gebildet werden.[6] In Knoblauch wird aus 13-HPOT durch eine Divinylethersynthase die Etherolensäure gebildet.[8]
Biosynthese
[Bearbeiten | Quelltext bearbeiten]Die Verbindung wird durch eine Lipoxygenase aus Linolensäure gebildet.[2]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c T. V. Savchenko, O. M. Zastrijnaja, V. V. Klimov: Oxylipins and plant abiotic stress resistance. In: Biochemistry (Moscow). Band 79, Nr. 4, April 2014, S. 362–375, doi:10.1134/S0006297914040051.
- ↑ a b c Tatyana Savchenko, Evgeny Degtyaryov, Yaroslav Radzyukevich, Vlada Buryak: Therapeutic Potential of Plant Oxylipins. In: International Journal of Molecular Sciences. Band 23, Nr. 23, 23. November 2022, S. 14627, doi:10.3390/ijms232314627, PMID 36498955, PMC 9741157 (freier Volltext).
- ↑ Jon C. Andre, Max O. Funk: Determination of stereochemistry in the fatty acid hydroperoxide products of lipoxygenase catalysis. In: Analytical Biochemistry. Band 158, Nr. 2, November 1986, S. 316–321, doi:10.1016/0003-2697(86)90556-7.
- ↑ K Matsui, A Minami, E Hornung, H Shibata, K Kishimoto, V Ahnert, H Kindl, T Kajiwara, I Feussner: Biosynthesis of fatty acid derived aldehydes is induced upon mechanical wounding and its products show fungicidal activities in cucumber. In: Phytochemistry. Band 67, Nr. 7, April 2006, S. 649–657, doi:10.1016/j.phytochem.2006.01.006.
- ↑ a b c Kenji Matsui, Chika Ujita, Sho-hei Fujimoto, Jack Wilkinson, Bill Hiatt, Vic Knauf, Tadahiko Kajiwara, Ivo Feussner: Fatty acid 9‐ and 13‐hydroperoxide lyases from cucumber 1. In: FEBS Letters. Band 481, Nr. 2, 15. September 2000, S. 183–188, doi:10.1016/S0014-5793(00)01997-9.
- ↑ Nathalie Tijet, Claus Schneider, Bernard L. Muller, Alan R. Brash: Biogenesis of Volatile Aldehydes from Fatty Acid Hydroperoxides: Molecular Cloning of a Hydroperoxide Lyase (CYP74C) with Specificity for both the 9- and 13-Hydroperoxides of Linoleic and Linolenic Acids. In: Archives of Biochemistry and Biophysics. Band 386, Nr. 2, Februar 2001, S. 281–289, doi:10.1006/abbi.2000.2218.
- ↑ Alexander N. Grechkin, Farit N. Fazliev, Lucia S. Mukhtarova: The lipoxygenase pathway in garlic ( Allium sativum L.) bulbs: detection of the novel divinyl ether oxylipins. In: FEBS Letters. Band 371, Nr. 2, 4. September 1995, S. 159–162, doi:10.1016/0014-5793(95)00895-G.