Nitrobenzylalkohole
| Nitrobenzylalkohole | ||||||
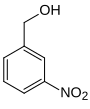
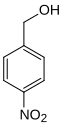
| Name | 2-Nitrobenzylalkohol | 3-Nitrobenzylalkohol | 4-Nitrobenzylalkohol | |||
| Andere Namen | o-Nitrobenzylalkohol WNR B1Q (WLN) 2NBA |
m-Nitrobenzylalkohol WNR C1Q (WLN) 3NBA |
p-Nitrobenzylalkohol WNR D1Q (WLN) 4NBA | |||
| Strukturformel | 
|
|
| |||
| CAS-Nummer | 612-25-9 | 619-25-0 | 619-73-8 | |||
| PubChem | 11923 | 69267 | 69275 | |||
| Summenformel | C7H7NO3 | |||||
| Molare Masse | 153,14 g·mol−1 | |||||
| Aggregatzustand | fest | |||||
| Schmelzpunkt | 69–72 °C[1] | 30–32 °C[2] | 92–94 °C[3] | |||
| Siedepunkt | 270 °C[4][1] |
175–180 °C (3 mmHg)[4][2] |
185 °C (12 mmHg)[4][3] | |||
| GHS- Kennzeichnung |
|
|
| |||
| H- und P-Sätze | keine H-Sätze | keine H-Sätze | keine H-Sätze | |||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||
| keine P-Sätze | keine P-Sätze | keine P-Sätze | ||||
Die Nitrobenzylalkohole bilden in der Chemie eine Stoffgruppe, die sich sowohl vom Benzylalkohol als auch vom Nitrobenzol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter Hydroxymethyl- (–CH2OH) und Nitrogruppe (–NO2) als Substituenten. Durch deren unterschiedliche Anordnung (ortho, meta oder para) ergeben sich drei Konstitutionsisomere mit der Summenformel C7H7NO3.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Nitrobenzylalkohole können durch Reduktion mit Natriumborhydrid (NaBH4) aus den Nitrobenzoylchloriden in wasserfreiem Dioxan dargestellt werden.[5] Ebenso sind sie durch Meerwein-Ponndorf-Verley-Reduktion aus den Nitrobenzaldehyden erhältlich.[6] Im basischen Medium disproportionieren die Nitrobenzaldehyde zu Nitrobenzoesäuren und Nitrobenzylalkoholen.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Nitrobenzylalkohole sind Feststoffe. Der 4-Nitrobenzylalkohol, der die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt.
Verwendung
[Bearbeiten | Quelltext bearbeiten]In der Massenspektrometrie findet der 3-Nitrobenzylalkohol (oft als „3-NBA“ abgekürzt) Verwendung als flüssige Matrix für das Fast Atom Bombardment[7] und die Matrix-unterstützte Laser-Desorption/Ionisation[8][9].
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Datenblatt 2-Nitrobenzylalkohol bei Sigma-Aldrich, abgerufen am 12. März 2017 (PDF).
- ↑ a b c Datenblatt 3-Nitrobenzylalkohol bei Sigma-Aldrich, abgerufen am 12. März 2017 (PDF).
- ↑ a b c Datenblatt 4-Nitrobenzylalkohol bei Sigma-Aldrich, abgerufen am 12. März 2017 (PDF).
- ↑ a b c CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Gattermann / Wieland: Die Praxis des organischen Chemikers, 43. Auflage, Walter de Gruyter, Berlin · New York 1982, ISBN 3-11-006654-8, S. 540–541: "p-Nitrobenzylalkohol".
- ↑ Darstellung von o-Nitrobenzylalkohol. ((PDF-Datei; 81 kB)) Ehemals im (nicht mehr online verfügbar); abgerufen am 30. Juli 2024. (Seite nicht mehr abrufbar. Suche in Webarchiven)
- ↑ J. Meili, J. Seibl: A new versatile matrix for fast atom bombardment analysis; in: Organic Mass Spectrometry, 1984, 19 (11), S. 581–582 (doi:10.1002/oms.1210191111).
- ↑ Shankai Zhao, Kasi V. Somayajula, Andrew G. Sharkey, David M. Hercules, Franz Hillenkamp, Michael Karas, Arndt Ingendoh: Novel Method for Matrix-Assisted Laser Mass Spectrometry of Proteins; in: Anal. Chem., 1991, 63 (5), S. 450–453 (doi:10.1021/ac00005a012).
- ↑ T-W. Dominic Chan, A. W. Colburn, Peter J. Derrick: Matrix-assisted laser desorption/ionization using a liquid matrix: Formation of high-mass cluster ions from proteins; in: Organic Mass Spectrometry, 1992, 27 (1), S. 53–56 (doi:10.1002/oms.1210270114).