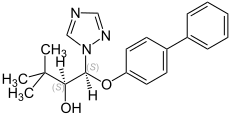
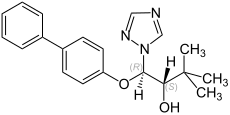Bitertanol
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeine Strukturformel ohne Angaben zur Stereochemie – Gemisch von vier Isomeren | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bitertanol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C20H23N3O2 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 337,42 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
1,16 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
300 °C (Zersetzung)[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Bitertanol ist ein Gemisch von vier isomeren chemischen Verbindungen aus den Gruppen der Triazole und der Biphenyl-Derivate.
Gewinnung und Darstellung
Bitertanol kann durch eine mehrstufige Reaktion von 3,3-Dimethylbutan-1-on durch eine Chlorierung mit elementaren Chlor, durch anschließender nucleophiler Substitution des Chloratoms mit 4-Phenylphenol, Bromierung mit elementaren Brom, erneuter nucleophilen Substitution mit 1,2,4-Triazol und Reduktion des Ketons mit Wasserstoff hergestellt werden.[4]

Eigenschaften
Bitertanol ist ein farbloser Feststoff, der unlöslich in Wasser ist.[1] Das technische Produkt ist eine 20:80 Mischung der (1RS,2RS)- und (1RS,2SR)-Isomere.
- Stereoisomere des Bitertanols mit Angabe der CIP-Konfiguration und des Gehalts im technischen Produkt
-
(1R,2R)-Bitertanol (ca. 10 %)
-
(1S,2S)-Bitertanol (ca. 10 %)
-
(1R,2S)-Bitertanol (ca. 40 %)
-
(1S,2R)-Bitertanol (ca. 40 %)
Es ist sehr stabil gegenüber Photolyse und Hydrolyse.[3][5] Die Halbwertszeit in wässriger Suspension beträgt 39,2 Tage.[2]
Verwendung
Bitertanol wird als Fungizid präventiv oder kurativ für die Bekämpfung bestimmter Krankheiten bei Obst und Gemüse verwendet, darunter Schorf und Monilia laxa bei Steinobst sowie zur Saatgutbehandlung gegen Fusarium spp., Septoria, Weizensteinbrand etc.[6] Es wurde 1979 von Bayer auf den Markt gebracht.[7]
Zulassung
Von der Europäischen Union wurde die Verwendung als Wirkstoff von Pflanzenschutzmitteln mit Wirkung zum 1. Januar 2012 für Anwendungen als Fungizid zur Saatgutbehandlung erlaubt.[8]
In Deutschland, Österreich und der Schweiz sind keine Pflanzenschutzmittel mit diesem Wirkstoff zugelassen.[9]
Einzelnachweise
- ↑ a b c d e f g Datenblatt Bitertanol, PESTANAL bei Sigma-Aldrich, abgerufen am 19. Mai 2017 (PDF).
- ↑ a b c F. Müller, P. Ackermann, P. Margot: Fungicides, Agricultural, 2. Individual Fungicides. In: Ullmanns Enzyklopädie der Technischen Chemie. Wiley-VCH, Weinheim 2012, doi:10.1002/14356007.o12_o06.
- ↑ a b c d e f EFSA: Conclusion on the peer review of the pesticide risk assessment of the active substance bitertanol, 2010. doi:10.2903/j.efsa.2010.1850
- ↑ Thomas A. Unger: Pesticide Synthesis Handbook. William Andrew, 1996, ISBN 0-08-095716-1, S. 685 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Terence Robert Roberts, David Herd Hutson: Metabolic Pathways of Agrochemicals: Part 2, Insecticides and fungicides. Royal Society of Chemistry, 1999, ISBN 0-85404-499-X, S. 1018 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ FAO: Bitertanol (PDF; 548 kB).
- ↑ Ulrich Schirmer, Peter Jeschke, Matthias Witschel: Modern Crop Protection Compounds: Herbicides. John Wiley & Sons, 2012, ISBN 978-3-527-32965-6, S. 771 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Durchführungsverordnung (EU) Nr. 1278/2011 der Kommission vom 8. Dezember 2011 zur Genehmigung des Wirkstoffs Bitertanol gemäß der Verordnung (EG) Nr. 1107/2009... (PDF).
- ↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Bitertanol in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 22. Februar 2016.