2,4,5-Triphenylimidazol
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2,4,5-Triphenylimidazol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C21H16N2 | |||||||||||||||
| Kurzbeschreibung |
weißer, meist durch Verunreinigung hellgelber Feststoff mit aromatischem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 296,37 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,0874 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt |
274–278 °C[1] | |||||||||||||||
| Siedepunkt |
427,96 °C[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
2,4,5-Triphenylimidazol (Trivialname: Lophin) ist ein Vertreter der Imidazole, welcher unter Einwirkung von UV-Licht fluoresziert und in basischem Medium chemoluminesziert. Es wurde 1877 erstmals von dem polnischen Chemiker Bronisław Radziszewski (1838–1914) als erste künstliche, organische, chemolumineszierende Verbindung dargestellt. In der heutigen Zeit findet Lophin in der chemischen Industrie Anwendung, ist aber aufgrund des deutlich bekannteren Luminols in Vergessenheit geraten.[2]
Darstellung
2,4,5-Triphenylimidazol kann durch die Radziszewski-Synthese (siehe unten) hergestellt werden.[2] Hierfür wird Benzil mit Benzaldehyd und Ammoniumacetat (als Ammoniakquelle) in Eisessig für etwa 1,5 Stunden bei 120–125 °C unter Rückfluss zum Sieden erhitzt. Bei direkter Zugabe der heißen Lösung in Eiswasser fällt verunreinigtes, gelbes 2,4,5-Triphenylimidazol aus. Dieses kann durch mehrfache Umkristallisation in Ethanol oder ähnlichen Lösungsmitteln und anschließender Ausfällung mit kochendem Wasser als reines, weißes Pulver erhalten werden.[4]

Fluoreszenz und Chemolumineszenz



2,4,5-Triphenylimidazol weist eine grüne Fluoreszenz auf. Das Absorptionsmaximum in Ethanol liegt bei 300 nm.[2]
Die Chemolumineszenz von Lophin läuft im basischen Medium ab. Dafür werden vier Lösungen (A–D) benötigt.
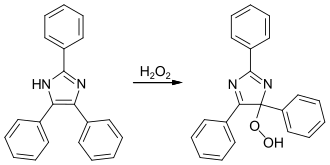
Lösung A besteht aus einer Lösung aus Lophin in Ethanol, Lösung B aus Wasserstoffperoxid in Ethanol, Lösung C aus Kaliumhydroxid in verdünntem Ethanol und Lösung D aus einer Natriumhypochloritlösung. Um die Chemolumineszenz zu starten, werden Lösungen A–C miteinander vermischt, wozu dann die Lösung D gegeben wird. Es entsteht eine gelbe Chemolumineszenz, welche in einem abgedunkelten Raum mit bloßem Auge zu betrachten ist.[5] Ein besonders gut zu beobachtendes Ergebnis lässt sich durch Erhitzen des Gemischs auf 40–45 °C erhalten.[2] Durch das Lösen der Edukte Kaliumhydroxid und Lophin in der kleinstmöglichen Menge Ethanol lässt sich eine hohe Konzentration erreichen, was sich ebenfalls positiv auf die Chemolumineszenz auswirkt.[6] Lophin wird durch Natriumhypochlorit in alkalischer, ethanolischer Lösung zu Benzoesäure und Ammoniak oxidiert.[7][8][2] Wird das Lophin mit Wasserstoffperoxid versetzt und mit ultraviolettem Licht der Wellenlänge 365 nm bestrahlt, lässt sich eine Dunkelblau/-Violettfärbung feststellen.[7] Dies ist auf die Bildung von Lophinhydroperoxiden, genauer gesagt 1,2-Dioxetanen zurückzuführen, welche instabil sind und durch ihre rote Farbe in Lösung zu erkennen sind. Diese weisen neben der Fluoreszenz auch eine Thermochemolumineszenz auf. Die Lophinhydroperoxide können durch Reaktion mit den Lophyl-Radikalen oder dem Dimer (siehe unten) synthetisiert werden.[9]
Radziszewski-Synthese
Bronisław Radziszewski (1838–1914) stellte Lophin ausgehend von Hydrobenzamid her, welches beim Erhitzen in Gegenwart von Luftsauerstoff bei Temperaturen von 120–130 °C zum giftigen Amarin cyclisiert. Dieses reagiert in Anwesenheit von Sauerstoff bei ca. 300 °C zum Lophin (2,4,5-Triphenylimidazol) weiter.
Das Hydrobenzamid stellte BR. Radziszewski durch das Mischen äquivalenter Lösungen von Ammoniak und Benzaldehyd und anschließendem Stehenlassen der Lösungen für mehrere Tage, bis das Produkt ausfiel, her. Eine Umkristallisation ist möglich.[2]
Der Nachteil des Verfahrens ist seine geringe Effizienz, weshalb die Route über Benzil von größerer Bedeutung ist.[2][5]

Dimerbildung
Das Dimer von Lophin weist verschiedene Eigenschaften auf, dazu gehören die Photochromie und die Piezochromie. Des Weiteren lässt sich eine Fluoreszenz feststellen.[10]
Die Synthese des Lophin-Dimers lässt sich durch eine Oxidation mit Kaliumhexacyanoferrat(II) darstellen. Dafür wird eine kalte Lösung von Kaliumhexacyanoferrat(II) in Wasser angefertigt, welche im Anschluss langsam und unter Rühren zu einer Lösung des Lophins in Ethanol, welcher vorher Kaliumhydroxid zugesetzt wurde, gegeben wird. Die Temperatur muss dabei bei 0–10 °C gehalten werden. Während der Zugabe entsteht eine violette Färbung der Lösung, woraufhin ein hellgrau bis hellviolettes Produkt ausfällt. Das Produkt wird filtriert und mit Ethanol gewaschen.[9][10]
Vorkommen
Polysubstituierte Imidazole werden aufgrund ihrer physiologischen Aktivitäten vor allem in der Medizin verwendet. Dazu zählen zum Beispiel die Synthese von Proteinkinase-Inhibitoren, Calciumantagonisten, kardiotonischen Mitteln und Antitumor-Medikamenten. Der Verbindungstyp findet auch Anwendung im Bereich der ionischen Flüssigkeiten. 2,4,5-Triphenylimidazol wird bei der Synthese von fluoreszierenden Diarylethenen und Nanodrähten verwendet, die als aktive Einzeldraht-Lichtwellenleiter und optisch angetriebene Ultraviolettlaser Anwendung finden.[1]
Weitere Anwendungen
2,4,5-Triphenylimidazol kann als Chemolumineszenzindikator bei Säure-Base-Titrationen verwendet werden. Lophin zeigt den Endpunkt im gleichen pH-Bereich wie Phenolphthalein an. Die Lichtemission erfolgt beim Umschlag von sauer zu basisch.[11]
In der Analytik wird Lophin verwendet um die Konzentration von Cobalt(II)-Ionen bis 0,01 ppb zu ermitteln. Es findet auch weitere Anwendungen in der Komplexometrie.[12]
Einzelnachweise
- ↑ a b c d e f g 2,4,5-TRIPHENYLIMIDAZOLE CAS#: 484-47-9. Abgerufen am 27. April 2023.
- ↑ a b c d e f g h i B.R. Radziszewski: Untersuchungen über Hydrobenzamid, Amarin und Lophin. In: Berichte der deutschen chemischen Gesellschaft. Band 10, Ausgabe 1, Januar 1877, S. 1280.
- ↑ a b Eintrag zu 2,4,5-Triphenylimidazole bei TCI Europe, abgerufen am 4. Juli 2023.
- ↑ Diana Yanover, Menahem Kaftory: Lophine (2,4,5-triphenyl-1H-imidazole). In: Acta Crystallographica Section E Structure Reports Online. Band 65, Nr. 4, 15. April 2009, S. o711–o711, doi:10.1107/S1600536809006552, PMID 21582448, PMC 2968781 (freier Volltext).
- ↑ a b Evans W. Cottman: Cold light brought into the classroom. In: Journal of Chemical Education. Band 14, Nr. 5, Mai 1937, S. 236, doi:10.1021/ed014p236.
- ↑ Verlag der Zeitschrift für Naturforschung: Zeitschrift für Naturforschung - Vol. 1, 1946 – Vol. 56, 2001. 9. März 2023, doi:10.17617/3.GRUJYR.
- ↑ a b J. C. Hummelen, T. M. Luider und H. Wynberg 191: Thermochemiluminescence immunoassay. Hrsg.: W. P. Collins, John Wiley & Sons: Chichester. 2. Auflage. EPRINTS-BOOK-TITLE University of Groningen, Stratingh Institute for Chemistry, 1988.
- ↑ Gonghao Lu, Jun Wada, Takashi Kimoto, Hiroshi Iga, Hideki Nishigawa, Masaru Kimura, Zhizhi Hu: The Chemiexcitation of the Chemiluminescence of Lophine Peroxide Anions via a Partially Cyclic Transition State: Chemiluminescence of Lophine Peroxide Anions. In: European Journal of Organic Chemistry. Band 2014, Nr. 6, Februar 2014, S. 1212–1219, doi:10.1002/ejoc.201300976.
- ↑ a b Joseph. Sonnenberg, Dwain M. White: Chemiluminescent and Thermochemiluminescent Lophine Hydroperoxide. In: Journal of the American Chemical Society. Band 86, Nr. 24, Dezember 1964, S. 5685–5686, doi:10.1021/ja01078a061.
- ↑ a b D. M. White, J. Sonnenberg: Oxidation of Triarylimidazoles. Structures of the Photochromic and Piezochromic Dimers of Triarylimidazyl Radicals 1. In: Journal of the American Chemical Society. Band 88, Nr. 16, August 1966, S. 3825–3829, doi:10.1021/ja00968a027.
- ↑ L. Erdey, I. Buzás: Lophine, a new chemiluminescent indicator. In: Analytica Chimica Acta. Band 15, 1. Juli 1956, S. 322–324, doi:10.1016/0003-2670(56)80059-7.
- ↑ Dean F. Marino, Fred. Wolff, J. D. Ingle: Determination of cobalt by lophine chemiluminescence. In: Analytical Chemistry. Band 51, Nr. 12, 1. Oktober 1979, S. 2051–2053, doi:10.1021/ac50048a041.