Isoprothiolan
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
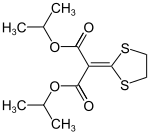
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Isoprothiolan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C12H18O4S2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 290,40 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (0,054 g·l−1 bei 25 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Isoprothiolan ist eine chemische Verbindung aus der Gruppe der Dithiolane und ein 1974 von Nihon Nōyaku eingeführtes Fungizid.[3] Isoprothiolan besitzt eine auffällige Keten-dithioacetal-Struktur.
Gewinnung und Darstellung
Isoprothiolan kann ausgehend von Diisopropylmalonat dargestellt werden, welches unter Anwesenheit von Natriumhydrid mit Kohlenstoffdisulfid reagiert. Das Produkt reagiert weiter mit 1,2-Dibromethan zu Isoprothiolan.[4]
Verwendung
Isoprothiolan ist ein systemisches Fungizid mit kurativer und protektiver Wirkung. Der Wirkstoff wird im Reisbau gegen verschiedene Pilzerkrankungen wie den Reisbrandpilz verwendet.[5][1]
Außerdem dient es der Behandlung des Fettlebersyndroms beim Rind.[6]
Zulassung
In den Staaten der EU und in der Schweiz sind keine Pflanzenschutzmittel mit diesem Wirkstoff zugelassen.[7]
Einzelnachweise
- ↑ a b c d e f Eintrag zu Isoprothiolan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 8. Januar 2015.
- ↑ a b Datenblatt Isoprothiolane bei Sigma-Aldrich, abgerufen am 21. Mai 2017 (PDF).
- ↑ Hiroki Ota: Historical Development of Pesticides in Japan S. 80–81.
- ↑ Thomas A. Unger: Pesticide Synthesis Handbook. William Andrew, 1996, ISBN 0-8155-1853-6, S. 734 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Takashi Hirooka, Yukio Miyagi, Fujio Araki, Hitoshi Kunoh, Hiroshi Ishizaki: The effect of isoprothiolane on the emergence of infection pegs from appressoria of Pyricularia oryzae. In: Pesticide Science. Band 13, Nr. 4, August 1982, S. 379–386, doi:10.1002/ps.2780130407.
- ↑ Y. Shimada, H. Katamoto, S. Ishida, K. Kobayashi, H. Tohzyoh: Therapeutic effect of isoprothiolane on bovine fat necrosis. In: Nihon juigaku zasshi. The Japanese journal of veterinary science. Band 50, Nummer 5, Oktober 1988, S. 1017–1024. PMID 3199611.
- ↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Isoprothiolane in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 26. März 2016.
