Kohlenstoffdisulfid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||
| Name | Kohlenstoffdisulfid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | CS2 | |||||||||||||||
| Kurzbeschreibung |
farblose, stark lichtbrechende Flüssigkeit, die im Reinzustand angenehm aromatisch, auf Grund von Verunreinigung jedoch meist unangenehm riecht[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 76,14 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
46 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex |
1,6319 (20 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
89,0 kJ/mol[7] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Kohlenstoffdisulfid (Trivialname: Schwefelkohlenstoff, CS2) ist ein Sulfid des Kohlenstoffs.
Geschichte[Bearbeiten | Quelltext bearbeiten]
Kohlenstoffdisulfid wurde 1796 von Wilhelm August Lampadius als Alcool sulfuris bei der Umsetzung von Schwefelkies mit Kohle entdeckt.[8] Im letzten Viertel des 19. Jahrhunderts gab es mehrere erfolglose Versuche, Kohlenstoffdisulfid als Arbeitsflüssigkeit für Dampfmaschinen einzusetzen.[9] Schwefelkohlenstoff wurde auf Grund seiner hohen Toxizität auch zur Vernichtung von Ratten[10] und Wühlmäusen[11] eingesetzt. Die toxische Wirkung wurde 1866 beschrieben.[12]
Wegen seiner guten Lösungsmitteleigenschaften wurde Schwefelkohlenstoff z. B. als Lösemittel für weißen Phosphor in Phosphorbomben oder bei der Vulkanisation von Kautschuk nach dem Kaltvulkanisationsverfahren verwendet. Dieses Verfahren wurde jedoch durch die Heißvulkanisation verdrängt.[13] Hauptanwendungsgebiet ist jedoch die Herstellung von Viskosefasern und Thiocarbamaten.

Die Bodeninjektion mit Schwefelkohlenstoff war eine wirksame, arbeitsaufwendige und teure Methode zur Bekämpfung der Reblaus. Man brachte den flüssigen, leicht verdunstenden, giftigen Schwefelkohlenstoff mit Handinjektoren in den Hauptwurzelbereich von befallenen Rebstöcken. Durch die Veredlung der Edelsorte mit einer widerstandsfähigen Unterlagsrebe wurde diese Möglichkeit überflüssig und ist seit 1997 verboten.[1]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Kohlenstoffdisulfid besitzt eine positive Standardbildungsenthalpie (für flüssiges CS2: ΔHf = +89,7 kJ/mol), die Synthese aus den Elementen ist damit eine endotherme Reaktion. Beim Zerfall in die Elemente Schwefel und Kohlenstoff kann die Verbindung den entsprechenden Energiebetrag wieder abgeben. Der Zerfall erfolgt jedoch nicht spontan, da es sich um eine metastabile Verbindung handelt.
Die Synthese aus den Elementen erfolgte bis in die 1950er Jahre unter Luftausschluss durch Überleitung von Schwefeldämpfen über glühende Holzkohle bei 800–1000 °C.[13]
Heutzutage wird Kohlenstoffdisulfid aus meist ungereinigtem Erdgas (oder anderen Quellen für Alkane wie z. B. Methan) und Schwefel bei 600 °C in Gegenwart von Katalysatoren synthetisiert. Bei dieser Reaktion entsteht außerdem Schwefelwasserstoff, der industriell weiterverarbeitet wird.[14]
Oftmals entsteht Schwefelkohlenstoff auch auf natürliche Art und Weise, zum Beispiel bei Fäulnisprozessen oder bei geologischen Prozessen.[15] Global gesehen hat Kohlenstoffdisulfid jedoch nur einen geringen Anteil an der gesamten Schwefelemission in die Atmosphäre.[16]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Physikalische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Kohlenstoffdisulfid ist eine farblose, stark lichtbrechende Flüssigkeit. In reinem Zustand riecht Schwefelkohlenstoff angenehm wie Ether; durch Verunreinigungen ist dieser etherische Geruch meist nicht mehr wahrnehmbar. Meist sind geringe Mengen von anderen Schwefelverbindungen die Ursache für einen teilweise widerlichen Geruch.[17]
Die Verbindung siedet unter Normaldruck bei 46,2 °C.[18][19] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,06683, B = 1168,62 und C = −31,616 im Temperaturbereich von 277 bis 353 K.[20] Die Verdampfungsenthalpie am Siedepunkt beträgt 26,7 kJ·mol−1.[21][20] Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=Aexp(−βTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 37,07 kJ/mol, β = 0,2264 und Tc = 552 K im Temperaturbereich zwischen 282 K und 319 K beschreiben.[21]
Kohlenstoffdisulfid ist mit Wasser nur sehr begrenzt mischbar. Mit zunehmender Temperatur ändern sich die Löslichkeiten von Kohlenstoffdisulfid in Wasser und von Wasser in Kohlenstoffdisulfid nur geringfügig.[19]
Löslichkeiten zwischen Kohlenstoffdisulfid und Wasser[19] Temperatur °C 0 10 20 30 40 Kohlenstoffdisulfid in Wasser in g/100 g 0,242 0,230 0,210 0,185 0,111 Wasser in Kohlenstoffdisulfid in g/100 g 0,0086 0,012 0,017 0,022
Die Verbindung ist ein gutes Lösungsmittel unter anderem für Iod, Schwefel, Selen, weißen Phosphor, Fette, Kautschuk und Harze sowie Cellulose. Außerdem ist es ein ausgezeichnetes Dielektrikum (Dielektrizitätskonstante εr = 2,632[22]).[13]
Das Kohlenstoffdisulfid-Molekül ist wie Kohlenstoffdioxid ein lineares Molekül mit einem sp-hybridisierten C-Atom und zwei (p-p)π-Bindungen.[23] Es ist isovalenzelektronisch zu Kohlenstoffdioxid und Carbonylsulfid.
Chemische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
CS2 verbrennt mit einer sehr niedrigen Temperatur (Flammentemperatur unter 200 °C) zu Kohlendioxid und Schwefeldioxid.
Die Verbindung reagiert mit Alkalilaugen, Sulfiden, Alkoholen, Ammoniak und Aminen sowie Chlor. Mit wässriger Alkalilauge werden die entsprechenden Trithiocarbonate und Carbonate gebildet.
Die Trithiocarbonate können auch durch die Umsetzung mit Alkalisulfiden erhalten werden.
Die Umsetzung mit Alkoholaten führt zu Xanthaten bzw. Dithiocarbonaten.
Die Reaktion mit Ammoniak ergibt in Abhängigkeit von der Konzentration und der Temperatur unterschiedliche Produkte, wie Ammoniumdithiocarbamat, Ammoniumtrithiocarbonat und Ammoniumthiocyanat.
Mit primären und sekundären Aminen werden die entsprechenden Dithiocarbamatsalze gebildet, wobei in Gegenwart von Alkalilauge die Alkalisalze erhalten werden.
Die Chlorierung kann verschiedene Chlorierungsprodukte, wie Tetrachlorkohlenstoff, Dischwefeldichlorid und Thiophosgen ergeben. Im Temperaturbereich zwischen 5 °C und 30 °C bildet sich mit guter Ausbeute in Abwesenheit einer Eisenkatalyse Trichlormethansulfenylchlorid.
Bei Temperaturen zwischen 70 °C und 100 °C und katalytisch wirkenden Eisensalzen wird Tetrachlorkohlenstoff zum Hauptprodukt. Primär gebildetes Dischwefeldichlorid reagiert mit Kohlenstoffdisulfid weiter zu Tetrachlorkohlenstoff und Schwefel.[19]
Die Hydrolyse führt bei höheren Temperaturen oberhalb von 150 °C zu Schwefelwasserstoff und Kohlendioxid, wobei Kohlenstoffoxysulfid als Zwischenprodukt auftritt.
Sicherheitstechnische Kenngrößen[Bearbeiten | Quelltext bearbeiten]
Kohlenstoffdisulfid bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt unterhalb von −20 °C. Der Explosionsbereich liegt zwischen 0,6 Vol.‑% (19 g/m3) als untere Explosionsgrenze (UEG) und 60,0 Vol.‑% (1900 g/m3) als obere Explosionsgrenze (OEG).[2][24] Der maximale Explosionsdruck beträgt 8,7 bar und die Sauerstoffgrenzkonzentration 4,6 Vol.‑%.[24] Die Grenzspaltweite wurde mit 0,37 mm bestimmt.[24] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIC.[2][24] Mit einer Mindestzündenergie von 0,009 mJ sind Dampf-Luft-Gemische extrem zündfähig.[2] Die Zündtemperatur beträgt 95 °C.[24] Der Stoff fällt somit in die Temperaturklasse T6 und ist der einzige, bisher bekannte Vertreter in dieser Temperaturklasse.
Toxikologie[Bearbeiten | Quelltext bearbeiten]
Da Schwefelkohlenstoff gut fettlöslich ist, wird es über Lunge und Haut leicht aufgenommen. Eine längere Exposition führt zu Vergiftungserscheinungen: Die akute Schwefelkohlenstoffvergiftung äußert sich in Gesichtsrötung, euphorischen Erregungszuständen, dann Bewusstlosigkeit, Koma und Atemlähmung; die chronische Schwefelkohlenstoffvergiftung durch wiederholtes längeres Einatmen äußert sich in Kopfschmerzen, Schlaflosigkeit, Gedächtnis-, Seh- und Hörstörungen, Nervenentzündungen sowie Gefäßschäden im Herzen und Gehirn.[25][26]
Verwendung und Reaktionen[Bearbeiten | Quelltext bearbeiten]
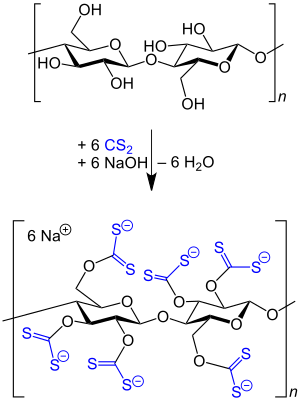
Schwefelkohlenstoff wird in großen Mengen zur Herstellung von Cellulosefasern aus Zellstoff eingesetzt, wobei der Zellstoff zuerst mit Natronlauge zu Alkalicellulose umgesetzt und diese nach dem oxidativen Abbau mit Schwefelkohlenstoff zu dem in Natronlauge löslichen Xanthogenat verarbeitet wird. Die so entstandene Celluloselösung, auch Viskose genannt, wird in schwefelsauren Spinnbädern zu Regeneratcellulose versponnen.[27][28][29]
Schwefelkohlenstoff ist ein Lösungsmittel für Fette, Harze, Gummi und Kautschuk.[30] Es wird in der Infrarot-Spektroskopie eingesetzt, da es keine störende Wasserstoff- oder Halogenbanden hat.[29] Außerdem zeigt Schwefelkohlenstoff einen starken Kerr-Effekt[31] und wird daher als Kerrlinse in Festkörperlasern eingesetzt.[32]
Kupferxanthogenate setzen unter Zersetzung giftigen Schwefelkohlenstoff frei, was früher zur Schädlingsbekämpfung eingesetzt wurde.[29]
Die Reduktion mit Natrium in Dimethylformamid ergibt das Dinatriumsalz von DMIT, Kurzbezeichnung für Dimercaptoisotrithion, einer Ausgangsverbindung zur Herstellung schwefelreicher Heterocyclen und von substituierten Tetrathiafulvalenen.[33]
Beim Kochen mit wässrigen Sulfid-Lösungen entstehen Trithiocarbonate. Bei der Reaktion mit Grignard-Verbindungen entstehen durch eine Insertionsreaktion Magnesiumsalze, deren Hydrolyse Dithiocarbonsäuren (R–CSSH) ergibt. Mit Ammoniak, primären und sekundären Aminen entstehen Dithiocarbamate.[34]
Spuren von Schwefelkohlenstoff (ca. 1 mg/l) werden dem Elektrolytbad bei der galvanischen Silberabscheidung als Glanzbildner hinzugegeben. Es verursacht einen sofortigen, vorübergehenden Abfall der kathodischen Polarisation. Dadurch ist es möglich, nahezu spiegelglänzende Silberschichten abzuscheiden.[35] Diese Wirkung als sogenannter Glanzbildner ist bereits seit Mitte des 19. Jahrhunderts bekannt.[36]
Kohlenstoffdisulfid hat den gleichen Brechungsindex wie Glas, daher ist in Kohlenstoffdisulfid eingetauchtes Glas praktisch unsichtbar. Dies wird beispielsweise zum Erkennen von gefälschten Diamanten verwendet. Echte Diamanten bleiben, anders als Glas, auch beim Eintauchen gut sichtbar. Es kann auch zur Synthese von künstlichen Diamanten eingesetzt werden.[37]
Nachweis[Bearbeiten | Quelltext bearbeiten]
Nasschemisch[Bearbeiten | Quelltext bearbeiten]
Kohlenstoffdisulfid gibt mit Diethylamin in Gegenwart von Kupfersalzen (Cu2+) einen gelben Dithiocarbamat-Komplex:[34][38]
Dieser Komplex wird auch zum Nachweis von Dämpfen mittels Prüfröhrchen genutzt.[1]
Andere Nachweisverfahren, wie die Bildung von roten Kristallen durch Reaktion mit Triethylphosphin, sind ebenfalls bekannt.[39]
In Abgasen und in der Luft[Bearbeiten | Quelltext bearbeiten]
Kohlenstoffdisulfid-Emissionen können mit einem iodometrischen Titrationsverfahren ermittelt werden, bei dem ein Teilstrom des zu beprobenden Abgases zunächst durch eine Cadmiumacetat-Lösung geleitet wird, um etwaigen Schwefelwasserstoff zu absorbieren. Die Bindung des Kohlenstoffdisulfids erfolgt in ethanolischer Kalilauge. Das so gewonnene Kaliumethylxanthogenat wird im Anschluss mit einer eingestellten Iodlösung titriert.[40] Dieses Verfahren wird erfolgreich in der Viskose verarbeitenden Industrie angewendet.
Gängige Verfahren zur Bestimmung von Kohlenstoffdisulfid in der Arbeitsplatzluft basieren auf der Adsorption an Aktivkohle mit anschließender Desorption und gaschromatographischer Analyse des desorbierten Stoffs.[41]
Risikobewertung[Bearbeiten | Quelltext bearbeiten]
Kohlenstoffdisulfid wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Kohlenstoffdisulfid waren die Besorgnisse bezüglich der Einstufung als CMR-Stoff, Umweltexposition, Exposition von Arbeitnehmern und hoher (aggregierter) Tonnage sowie als potentieller endokriner Disruptor. Die Neubewertung fand ab 2013 statt und wurde von Frankreich durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[42][43]
Siehe auch[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f Eintrag zu Schwefelkohlenstoffe. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. März 2013.
- ↑ a b c d e f g h i j k l m n Eintrag zu Kohlendisulfid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b Datenblatt Kohlenstoffdisulfid bei Alfa Aesar, abgerufen am 9. Februar 2010 (Seite nicht mehr abrufbar).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-88.
- ↑ Eintrag zu Carbon disulphide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-15-0 bzw. Kohlenstoffdisulfid), abgerufen am 2. November 2015.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- ↑ Richard Dietrich: Lampadius, Wilhelm August. In: Neue Deutsche Biographie (NDB). Band 13, Duncker & Humblot, Berlin 1982, ISBN 3-428-00194-X, S. 456 f. (Digitalisat).
- ↑ The Museum of RetroTechnology: Carbon Disulphide Engines.
- ↑ Ratten. In: Meyers Großes Konversations-Lexikon. 6. Auflage. Band 16: Plaketten–Rinteln. Bibliographisches Institut, Leipzig / Wien 1908, S. 620 (zeno.org).
- ↑ Wühlmaus. In: Meyers Großes Konversations-Lexikon. 6. Auflage. Band 20: Veda–Zz. Bibliographisches Institut, Leipzig / Wien 1909, S. 763–764 (zeno.org).
- ↑ S. Cloëz: Ueber die giftigen Eigenschaften des Schwefelkohlenstoffs und über die Anwendung dieser Flüssigkeit zur Vertilgung der Ratten und der in der Erde lebenden schädlichen Thiere. In: Polytechnisches Journal. 182, 1866, S. 185.
- ↑ a b c Friedrich Warnecke: Die gewerbliche Schwefelkohlenstoffvergiftung. In: Archiv für Gewerbepathologie und Gewerbehygiene. Band 11, Nr. 2, Dezember 1941, S. 198, doi:10.1007/bf02122927.
- ↑ WADDAMS: Chemische Produkte aus Erdöl Zur Einführung und Übersicht. Springer-Verlag, 2013, ISBN 978-3-0348-6885-3, S. 60 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Peter Fabian: Atmosphäre und Umwelt Chemische Prozesse - Menschliche Eingriffe - Ozon-Schicht - Luftverschmutzung Smog - Saurer Regen. Springer-Verlag, 2013, ISBN 978-3-662-00599-6, S. 68 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Alan R. Wellburn: Luftverschmutzung und Klimaänderung Auswirkungen auf Flora, Fauna und Mensch. Springer-Verlag, 2013, ISBN 978-3-642-59037-5, S. 104 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Fachlexikon Chemie, Harry Deutsch Verlag, Frankfurt am Main, 1979.
- ↑ Boublik, T.; Aim, K.: Heats of Vaporization of Simple Non-spherical Molecule Compounds in Collect. Czech. Chem. Commun. 37 (1972) 3513.
- ↑ a b c d M.D.S. Lay; M.W. Sauerhoff, D.R. Saunders: Carbon Disulfide, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2012; doi:10.1002/14356007.a05_185.
- ↑ a b Waddington, G.; Smith, J.C.; Williamson, K.D.; Scott, D.W.: Carbon Disulfide as a Reference substance for Vapor-Flow Calorimetry; The Chemical Thermodynamic Properties in J. Phys. Chem. 66 (1962) 1074–1077, doi:10.1021/j100812a025.
- ↑ a b V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Permittivity (Dielectric Constant) of Liquids, S. 6-150.
- ↑ Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 978-3-11-022567-9, S. 534 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ Karlheinz Lohs, Ursula Stephan: Fachlexikon Toxikologie. Springer-Verlag, 2008, ISBN 978-3-540-27337-0, S. 401 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Harald Taeger: Die Klinik der entschädigungspflichtigen Berufskrankheiten. Springer-Verlag, 2013, ISBN 978-3-642-94515-1, S. 221 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 652.
- ↑ Umweltbundesamt: Kohlenstoffdisulfid Stand: 03/2003, abgerufen am 5. Mai 2016.
- ↑ a b c Hermann Sicius: Kohlenstoffgruppe: Elemente der vierten Hauptgruppe Eine Reise durch das Periodensystem. Springer-Verlag, 2015, ISBN 978-3-658-11166-3, S. 16 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Müfit Bahadir, Harun Parlar, Michael Spiteller: Springer Umweltlexikon. Springer-Verlag, 2013, ISBN 978-3-642-97335-2, S. 926 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. J. Chenoweth, O. L. Gaddy, D. F. Holshouser: Carbon Disulfide Traveling-Wave Kerr Cells. In: Applied Optics. 5, 1966, S. 1652, doi:10.1364/AO.5.001652.
- ↑ N. G. Basov: High-Power Lasers and Laser Plasmas / Moshchnye Lazery I Lazernaya Plazma / Мощные Лазеры И Лазерная Плазма. Springer Science & Business Media, 2012, ISBN 978-1-4684-1632-9, S. 36 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Angelica Heinrich: Synthesen von Tetrathiafulvalen(TTF)-Kohlenhydratderivaten und deren Aktivitäten im MTT-Test. Dissertation. 2003, urn:nbn:de:bsz:21-opus-10112 abgerufen am 5. Mai 2016.
- ↑ a b Arnold F. Holleman, Egon Wiberg: Lehrbuch der anorganischen Chemie. de Gruyter, 1995, ISBN 3-11-012641-9, S. 872 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Neuzeitliche galvanische Metallabscheidung. Carl Hanser Verlag, München 1953.
- ↑ Pierer's Universal-Lexikon. Band 18, Altenburg 1864, S. 517–519.
- ↑ Greg D. Barber, Walter A. Yarbrough: Synthesis of Diamond from Carbon Disulfide in Hydrogen. In: Journal of the American Ceramic Society. 78, 1995, S. 3390, doi:10.1111/j.1151-2916.1995.tb07983.x.
- ↑ F. Feigl, K. Weisselberg: Beiträge zum Nachweis von Schwefelkohlenstoff. In: Zeitschrift für Analytische Chemie. 83, 1931, S. 93, doi:10.1007/BF01361030.
- ↑ F. K. Beilstein: Handbuch der organischen Chemie. Leopold Voss, 1928, ISBN 978-5-88502-336-8, S. 880 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ VDI 3487 Blatt 1:1978-11 Messen gasförmiger Emissionen; Messen der Schwefelkohlenstoff-Konzentration; Jodometrisches Titrationsverfahren. VDI-Verlag, Düsseldorf, S. 2.
- ↑ Thomas Göen, Peter Kredel, Norbert Lichtenstein, Gerda Ruppert, Dieter Stevenz, Ulrich Stöcker: Quality improvement and quality testing for the determination of carbon disulphide at workplaces. In: Gefahrstoffe – Reinhalt. Luft. 62, Nr. 3, 2002, S. 103–105.
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- ↑ Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Carbon disulphide, abgerufen am 28. November 2023.





















![{\displaystyle \mathrm {[Cu^{II}{(SC(S)N(C_{2}H_{5})_{2})}_{2}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/b00dc6fe859aaf920aed65edfff42c495a44da4b)