Aetokthonotoxin
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||
| Allgemeines | ||||||||||
| Name | Aetokthonotoxin | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C17H6Br5N3 | |||||||||
| Kurzbeschreibung | ||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 651,77 g·mol−1 | |||||||||
| Schmelzpunkt |
258–260 °C[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Aetokthonotoxin (AETX) ist eine chemische Verbindung aus der Stoffgruppe der Indolalkaloide und ein Neurotoxin.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Ausgehend von Indolin und 5-Bromindol kann Aetokthonotoxin in einer fünfstufigen Totalsynthese dargestellt werden.
Zunächst wird Indolin mit Pyridiniumtribromid zum 5,7-Dibromindolin bromiert und dieses mit Wasserstoffperoxid und Natriumwolframat in die N-Hydroxylverbindung überführt, die ohne Zwischenisolierung mit Dimethylsulfat zum 5,7-Dibrom-1-methoxy-1H-indol methyliert wird. Mit Chlorsulfonylisocyanat wird anschließend das 5,7-Dibrom-1-methoxy-1H-indol-3-carbonitril hergestellt. Die Umsetzung dieser Zwischenstufe mit 5‑Bromindol und Natriumhydrid führt in einer Michael-Addition zu einem Tribrombiindol, das abschließend mit N-Bromsuccinimid zu Aetokthonotoxin bromiert wird.[4]
Effekte
[Bearbeiten | Quelltext bearbeiten]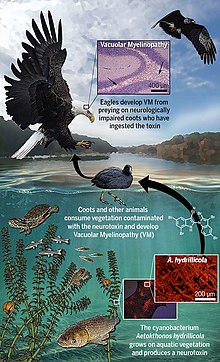
Das durch das Cyanobakterium Aetokthonos hydrillicola gebildete Neurotoxin verursacht eine Myelopathie mit Vakuolenbildung in der weißen Substanz des Gehirns (engl. Avian vacuolar myelinopathy ‚aviäre vakuoläre Myelinopathie‘).[1] Die Krankheit wurde 1994 erstmals bei Weißkopfseeadlern diagnostiziert,[5] das Toxin aber erst 2021 identifiziert.[1] Da die Biosynthese von Aetokthonotoxin von der Verfügbarkeit von Bromid in Süßwassersystemen abhängt und ein Zusammenspiel zwischen dem toxinproduzierenden Cyanobakterium und der Wirtspflanze, Hydrilla verticillata, auf der es epiphytisch wächst, erfordert, dauerte es lange bis Aetokthonotoxin als das auslösende Toxin entdeckt wurde. Das Toxin reichert sich über die Nahrungskette an.[6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Steffen Breinlinger, Tabitha J. Phillips, Brigette N. Haram, Jan Mareš, José A. Martínez Yerena, Pavel Hrouzek, Roman Sobotka, W. Matthew Henderson, Peter Schmieder, Susan M. Williams, James D. Lauderdale: Hunting the eagle killer: A cyanobacterial neurotoxin causes vacuolar myelinopathy. In: Science. Band 371, Nr. 6536, 26. März 2021, S. eaax9050, doi:10.1126/science.aax9050.
- ↑ a b Manuel G. Ricardo, Markus Schwark, Dayma Llanes, Timo H. J. Niedermeyer, Bernhard Westermann: Total Synthesis of Aetokthonotoxin, the Cyanobacterial Neurotoxin Causing Vacuolar Myelinopathy. Supporting Information. In: Chemistry – A European Journal. 3. Juni 2021, doi:10.1002/chem.202101848 (Supporting Information [PDF]).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Manuel G. Ricardo, Markus Schwark, Dayma Llanes, Timo H. J. Niedermeyer, Bernhard Westermann: Total Synthesis of Aetokthonotoxin, the Cyanobacterial Neurotoxin Causing Vacuolar Myelinopathy. In: Chemistry – A European Journal. 3. Juni 2021, doi:10.1002/chem.202101848.
- ↑ Avian Vacuolar Myelinopathy ( vom 13. Mai 2017 im Internet Archive), National Wildlife Health Center.
- ↑ Anna H. Birrenkott, Susan B. Wilde, John J. Hains, John R. Fischer, Thomas M. Murphy: Establishing a food-chain link between aquatic plant material and avian vacuolar myelinopathy in mallards (Anas platyrhynchos). In: Journal of Wildlife Diseases. Band 40, Nr. 3, Juli 2004, S. 485–492, doi:10.7589/0090-3558-40.3.485.