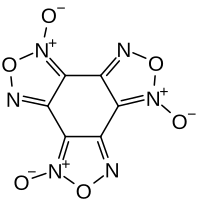
Benzotrifuroxan
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Benzotrifuroxan | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C6N6O6 | |||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 252,103 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
1,87 g·cm−3[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Benzotrifuroxan ist eine heterocyclische organische Verbindung, die der Gruppe der 1,2,5-Oxadiazole zugeordnet werden kann. Es leitet sich formal vom nicht existierenden Hexanitrosobenzol ab. Bei der energiereichen Verbindung handelt es sich um einen Explosivstoff.
Geschichte[Bearbeiten | Quelltext bearbeiten]
Die Verbindung wurde erstmals 1924 von O. Turek als Hexanitrosobenzol synthetisiert.[5][6] Neben der Hexanitrosostruktur könnten auch symmetrische polycyclische Strukturen formuliert werden.

Untersuchungen mittels IR- und Raman-Spektroskopie[7] sowie Einkristallröntgenbeugung[2] zeigten, dass diese Strukturen nicht real sind und die Verbindung als tetracyclische Benzotrifuroxanstruktur vorliegt.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Benzotrifuroxan kann durch den thermischen Abbau von 1,3,5-Triazido-2,4,6-trinitrobenzol erhalten werden.[5][6]

Eine weitere Synthese kann durch die Umsetzung von 5,7-Dichlor-4,6-dinitronbenzofuroxan mit Natriumazid erfolgen.[8]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Physikalische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Benzotrifuroxan ist ein kristalliner Feststoff, der bei 195 °C schmilzt.[3] Die Verbindung kristallisiert in einem orthorhombischen Kristallgitter mit der Raumgruppe Pna21.[2][9] Die molare Bildungsenthalpie beträgt 606 kJ·mol−1, die Verbrennungsenthalpie −2967 kJ·mol−1.[10]
Chemische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Benzotrifuroxan kann explosionsartig zerfallen. Die Explosionswärme beträgt 5903 kJ·kg−1[11], die Detonationsgeschwindigkeit 8,61 km·s−1.[12] Die Verbindung ist schlagempfindlich.[13]
Benzotrifuroxan bildet mit aromatischen Kohlenwasserstoffen wie Naphthalin, 1-Phenylnaphthalin, 2-Phenylnaphthalin und Tetrahydronaphthalin stabile Komplexe. Eine Umkristallisation in Benzol ergibt einen 1:1-Komplex, wobei das Benzol erst bei 100 °C im Vakuum entfernt werden kann.[1]
Verwendung[Bearbeiten | Quelltext bearbeiten]
In Kombination mit TNT kann die Verbindung zur Herstellung von Nanodiamanten durch Detonationsschockwellen verwendet werden.[14]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b A. S. Bailey, J. R. Case: 4:6-dinitrobenzofuroxan, nitrobenzodifuroxan and benzotrifuroxan: A new series of complex-forming reagents for aromatic hydrocarbons. In: Tetrahedron. Band 3, Nr. 2, 1958, S. 113–131, doi:10.1016/0040-4020(58)80003-4.
- ↑ a b c H. H. Cady, A. C. Larson, D. T. Cromer: The Crystal Structure of Benzotrifuroxan (Hexanitrosobenzene). In: Acta Crystallographica. Band 20, Nr. 3, 1. März 1966, S. 336–341, doi:10.1107/S0365110X6600080X.
- ↑ a b J. C. A. Boeyens, F. H. Herbstein: Molecular Compounds and Complexes. II. Exploratory Crystallographic Study of Some Donor-Acceptor Molecular Compounds1. In: The Journal of Physical Chemistry. Band 69, Nr. 7, 1. Juli 1965, S. 2153–2159, doi:10.1021/j100891a003.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b O. Turek: Le 2,4,6-trinitro-1,3,5-triazido-benzene, nouvel explosif d’amorcage. In: Chimie et industrie. Band 26, 1931, S. 781–794.
- ↑ a b O. Turek: 1,3,5-Triazido-2,4,6-trinitrobenzen, nova inicialna vybusina. In: Chemicky obzor. Nr. 7, 1932, S. 76–79; 97–104.
- ↑ Neville Bacon, A. J. Boulton, A. R. Katritzky: Structure of “hexanitrosobenzene” from vibrational spectroscopy. In: Transactions of the Faraday Society. Band 63, Nr. 0, 1. Januar 1967, S. 833–835, doi:10.1039/TF9676300833.
- ↑ E. A. Chugunova, R. E. Timasheva, E. M. Gibadullina, A. R. Burilov, R. Goumont: First Synthesis of Benzotrifuroxan at Low Temperature: Unexpected Behavior of 5,7-Dichloro-4,6-dinitrobenzo-furoxan with Sodium Azide. In: Propellants, Explosives, Pyrotechnics. Band 37, Nr. 4, 20. Juli 2012, S. 390–392, doi:10.1002/prep.201200080.
- ↑ E. N. Maslen: A phase refinement of the crystal structure of benzotrifuroxan. In: Acta Crystallographica Section B, Structural Crystallography and Crystal Chemistry. Band 24, Nr. 9, 1. September 1968, S. 1170–1172, doi:10.1107/S0567740868003912.
- ↑ Prince E. Rouse: Enthalpies of formation and calculated detonation properties of some thermally stable explosives. In: Journal of Chemical & Engineering Data. Band 21, Nr. 1, 1. Januar 1976, S. 16–20, doi:10.1021/je60068a026.
- ↑ Betsy M. Rice, Jennifer Hare: Predicting heats of detonation using quantum mechanical calculations. In: Thermochimica Acta. Band 384, Nr. 1–2, 25. Februar 2002, S. 377–391, doi:10.1016/S0040-6031(01)00796-1.
- ↑ H. Muthurajan, R. Sivabalan, M. B. Talawar, S. N. Asthana: Computer simulation for prediction of performance and thermodynamic parameters of high energy materials. In: Journal of Hazardous Materials. Band 112, Nr. 1–2, 9. August 2004, S. 17–33, doi:10.1016/j.jhazmat.2004.04.012.
- ↑ V. I. Pepekin, B. L. Korsunskii, A. A. Denisaev: Initiation of solid explosives by mechanical impact. In: Combustion, Explosion, and Shock Waves. Band 44, Nr. 5, 1. September 2008, S. 586–590, doi:10.1007/s10573-008-0089-7.
- ↑ N. V. Kozyrev: Using the tracer method to study detonation processes. In: Combustion, Explosion, and Shock Waves. Band 44, Nr. 6, 1. November 2008, S. 698–703, doi:10.1007/s10573-008-0105-y.