Bexaroten
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Bexaroten | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C24H28O2 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes, kristallines Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 348,48 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Bexaroten (Handelsname Targretin; Hersteller Eisai) ist der internationale Freiname für ein synthetisches Retinoid-Analogon, das zur Behandlung des kutanen T-Zell-Lymphoms zugelassen ist. Vertrieben wird es in Deutschland von Cephalon.[4][5]
Klinische Anwendung[Bearbeiten | Quelltext bearbeiten]
In den Vereinigten Staaten wurde Bexaroten im Jahr 1999 zur oralen Einnahme bei der Behandlung des kutanen T-Zell-Lymphoms bei Patienten zugelassen, die nicht mehr auf eine vorherige systemische Therapie ansprechen, das heißt refraktär sind. In Deutschland wurde es im Januar 2002 als Orphan-Arzneimittel für diese seltene bösartige Hauterkrankung zugelassen. Auch hier darf es erst dann zur Anwendung kommen, wenn mindestens eine vorausgegangene systemische Behandlung nicht wirksam war und zudem die Krankheit in einem fortgeschrittenen Stadium ist.[6]
Der Wirkungsmechanismus von Bexaroten ist noch nicht vollständig aufgeklärt. Es bindet als Retinoid spezifisch an den Retinoid-X-Rezeptor (RXR). Die Retinoid-X-Rezeptoren sind Transkriptionsfaktoren, die die Zellproliferation und -differenzierung, sowie Apoptose und Insulin-Sensibilisierung beeinflussen. Bei In-vitro-Versuchen konnte eine Proliferationshemmung bei blutbildenden Zellen festgestellt werden. Im Tierversuch bewirkte es eine Tumorregression, das heißt eine Rückentwicklung der bösartigen Geschwulst.[6]
Zulassungsüberschreitend (Off-Label-Use) wird Bexaroten auch zur Behandlung des Bronchialkarzinoms eingesetzt.[7]
Nebenwirkungen[Bearbeiten | Quelltext bearbeiten]
In den klinischen Studien zur Zulassung von Bexaroten zur Behandlung des kutanen T-Zell-Lymphoms wurden bei den Patienten vor allem folgende Nebenwirkungen festgestellt: Hyperlipoproteinämie (vor allem Triglyceride) 74 % der Patienten, Hypothyreose (29 %), Hypercholesterinämie (28 %), Kopfschmerzen (27 %), Leukopenie (20 %), Juckreiz (20 %), Asthenie (19 %), Exanthem (16 %), exfoliative Dermatitis (15 %) und Schmerzen (12 %).[8]
Präklinische Ergebnisse zur Alzheimer-Krankheit[Bearbeiten | Quelltext bearbeiten]
Für Aufsehen sorgte ein am 9. Februar 2012 veröffentlichter Artikel in Science.[9] In dieser Publikation wird die potenzielle Wirkung von Bexaroten im Tiermodell Farbmaus bei der Alzheimer-Krankheit beschrieben. Dabei beseitigte die Verabreichung von Bexaroten bei den transgenen Mäusen nicht nur vorhandene und für die Alzheimer-Krankheit typische Protein-Plaques, die nach der Plaques-Theorie der Grund für die Alzheimer-Symptome sein sollen, sondern auch die Gedächtnisstörungen. Bexaroten kann als sehr unpolares und relativ kleines Molekül die Blut-Hirn-Schranke überwinden. Dort beeinflusst es die Expression von Apolipoprotein E, das in größeren Mengen produziert wird und den Abbau der senilen Plaques, vor allem β-Amyloid, ermöglicht.[10]
Derzeit ist noch unklar, ob diese Ergebnisse auch auf den Menschen übertragen werden können. Die Autoren des Science-Artikels wiesen darauf hin, dass es viele bekannte Methoden gibt, mit denen sich Alzheimer bei Mäusen heilen lässt, die aber alle nicht beim Menschen funktionierten.
Nachfolgende präklinische Versuche anderer Forschungsgruppen konnten die vielversprechenden Ergebnisse nicht bestätigen.[11][12][13]
Für die Behandlung der Alzheimer-Krankheit ist Bexaroten nicht zugelassen.
Synthese[Bearbeiten | Quelltext bearbeiten]
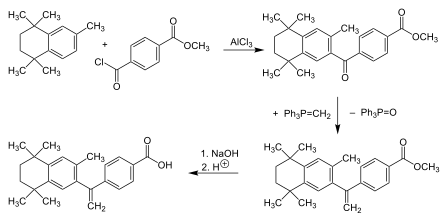
Entwicklungsgeschichte[Bearbeiten | Quelltext bearbeiten]
Entwickelt wurde Bexaroten von dem US-amerikanischen Unternehmen Ligand Pharmaceuticals, das Targretin und drei weitere potentielle Krebstherapeutika 2006 für 205 Millionen US$ an das japanische Unternehmen Eisai verkaufte. Das Stoffpatent (siehe Originalpräparat) lief 2016 aus.[15]
Weiterführende Literatur[Bearbeiten | Quelltext bearbeiten]
- L. Qu, X. Tang: Bexarotene: a promising anticancer agent. In: Cancer Chemotherapy and Pharmacology. Band 65, Nummer 2, Januar 2010, S. 201–205, doi:10.1007/s00280-009-1140-4. PMID 19777233.
- S. M. Horwitz: Novel therapies for cutaneous T-cell lymphomas. In: Clinical lymphoma & myeloma. Band 8 Suppl 5, Dezember 2008, S. S187–S192, doi:10.3816/CLM.2008.s.015. PMID 19073526.
- R. Gniadecki, C. Assaf u. a.: The optimal use of bexarotene in cutaneous T-cell lymphoma. In: British Journal of Dermatology. Band 157, Nummer 3, September 2007, S. 433–440, doi:10.1111/j.1365-2133.2007.07975.x. PMID 17553039.
- C. Querfeld, L. V. Nagelli u. a.: Bexarotene in the treatment of cutaneous T-cell lymphoma. In: Expert Opinion on Pharmacotherapy. Band 7, Nummer 7, Mai 2006, S. 907–915, doi:10.1517/14656566.7.7.907. PMID 16634713.
- J. Bohmeyer, R. Stadler u. a.: Bexaroten – eine Therapie-Alternative für fortgeschrittene kutane T-Zell-Lymphome? Erste Erfahrungen. In: JDDG. Band 1, Nummer 10, Oktober 2003, S. 785–789, doi:10.1046/j.1439-0353.2003.03711.x
- P. Altmeyer: Bexaroten (Memento vom 21. März 2013 im Internet Archive) In: Enzyklopädie der Dermatologie, Venerologie, Allergologie, Umweltmedizin Springer-Verlag Berlin Heidelberg, 2008, ISBN 3-540-41361-8, S. 128. eingeschränkte Vorschau in der Google-Buchsuche.
- wbr/dapd: Krebsmittel vertreibt Alzheimer-Symptome. In: Spiegel Online. Vom 10. Februar 2012.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f Material Safety Data Sheet - LC Laboratories Cat. No. B-2422. (Memento vom 9. Mai 2015 im Internet Archive) Vom 8. November 2008.
- ↑ Eintrag zu Bexaroten. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Februar 2016.
- ↑ a b Datenblatt Bexarotene, 99+% bei Alfa Aesar, abgerufen am 1. November 2016 (Seite nicht mehr abrufbar).
- ↑ Gelbe Liste (Memento vom 31. Juli 2012 im Webarchiv archive.today), abgerufen am 11. Februar 2012.
- ↑ EMA: EPAR-Product Information (PDF; 264 kB), abgerufen am 11. Februar 2012.
- ↑ a b Bexaroten Targretin® Weichkapseln (Elan Pharma). In: Pharmazeutische Zeitung. Abgerufen am 10. Februar 2012.
- ↑ H. Fritz, D. Kennedy u. a.: Vitamin A and retinoid derivatives for lung cancer: a systematic review and meta analysis. In: PloS one. Band 6, Nummer 6, 2011, S. e21107, doi:10.1371/journal.pone.0021107. PMID 21738614. PMC 3124481 (freier Volltext).
- ↑ Zusammenfassung der Merkmale des Arzneimittels. (PDF; 264 kB) Europäische Arzneimittel-Agentur, abgerufen am 10. Februar 2012.
- ↑ P. E. Cramer, J. R. Cirrito u. a.: ApoE-Directed Therapeutics Rapidly Clear β-Amyloid and Reverse Deficits in AD Mouse Models. In: Science. doi:10.1126/science.1217697
- ↑ Wirkstoff Bexaroten beseitigt Gedächtnisstörungen und Eiweiß-Plaques bei Mäusen. In: scinexx. Vom 10. Februar 2012.
- ↑ E. O’Hare, R. Jeggo u. a.: Lack of support for bexarotene as a treatment for Alzheimer's disease. In: Neuropharmacology. [elektronische Veröffentlichung vor dem Druck] Mai 2015, doi:10.1016/j.neuropharm.2015.04.020, PMID 26025659.
- ↑ C. Balducci, A. Paladini u. a.: The Continuing Failure of Bexarotene in Alzheimer's Disease Mice. In: Journal of Alzheimer's disease : JAD. [elektronische Veröffentlichung vor dem Druck] März 2015, doi:10.3233/JAD-150029, PMID 25777514.
- ↑ B. Tousi: The emerging role of bexarotene in the treatment of Alzheimer's disease: current evidence. In: Neuropsychiatric disease and treatment. Band 11, 2015, S. 311–315, doi:10.2147/NDT.S61309, PMID 25709453, PMC 4327563 (freier Volltext) (Review).
- ↑ Patent US5780676: Compounds having selective activity for Retinoid X Receptors, and means for modulation of processes mediated by Retinoid X Receptors. Angemeldet am 7. Juni 1995, veröffentlicht am 14. Juli 1998, Anmelder: Ligand Pharmaceuticals, Erfinder: Marcus F. Boehm, Richard A. Heyman, Lin Zhi, Chan Kou Hwang, Steve White, Alex Nadzan.
- ↑ B. Glenn: CWRU researchers: Drug shows promise in reducing Alzheimer’s plaque in brain. In: medcitynews.com vom 9. Februar 2012.