Cholinester

Cholinester sind eine Stoffgruppe der organischen Chemie. Es handelt sich um Ester, meist Carbonsäureester, des Cholins. Als Derivate des Cholins sind sie quartäre Ammoniumverbindungen. Der bekannteste Vertreter ist das Acetylcholin, das verschiedene biologische Funktionen einnimmt, unter anderem als Neurotransmitter. Der Cholinester Sinapin kommt in Kreuzblütlern vor, außerdem sind Cholinester wichtige Metabolite verschiedener Meeresschnecken. Phosphorsäureester des Cholins sind unter anderem Bestandteil von Phospholipiden.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Acetylcholin und verwandte Verbindungen
[Bearbeiten | Quelltext bearbeiten]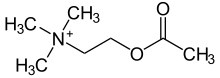
Acetylcholin ist ein wichtiges und weitverbreitetes Signalmolekül in allen Lebewesen. In Wirbeltieren wirkt es als Neurotransmitter, beeinflusst aber auch viele andere Prozesse.[1] In Pflanzen kommt Acetylcholin verstärkt in schnell wachsenden Teilen vor, beispielsweise in sehr hohen Konzentrationen in Bambussprossen und reguliert vermutlich die Zellteilung.[2] Andere Cholinester haben als Signalmoleküle ebenfalls Bedeutung, die gegenüber Acetylcholin jedoch deutlich untergeordnet ist. Propionylcholin und Butyrylcholin sind beispielsweise an der Regulierung des Ionentransports durch das Darmepithel beteiligt.[3]
Andere Carbonsäureester des Cholins
[Bearbeiten | Quelltext bearbeiten]
In den Stachelschnecken kommen verschiedene bioaktive Cholinester wie das Urocanylcholin vor.[5] Diese dienen vermutlich unter anderem dazu, Beutetiere zu lähmen und als antibakterielle Wirkstoffe, um die Eier zu schützen. Daneben treten sie auch als Gegenionen des biosynthetischen Sulfat-Vorläufers von Purpur auf.[4] Einige in Kofferfischen vorkommende Neurotoxine, beispielsweise das Pahutoxin, sind Cholinester.[6]
Sinapin ist der Cholinester der Sinapinsäure und kommt in den Samen der Kreuzblütler vor.[7] Es ist auch das Gegenion des Glucosinalbins im Sinalbin, einem wichtigen Inhaltsstoff von weißem Senf.[8]
Phosphorsäureester des Cholins
[Bearbeiten | Quelltext bearbeiten]Der Phosphorsäureester des Cholins, das Phosphocholin, ist in biologischen Systemen an der Biosynthese diverser anderer Moleküle beteiligt, darunter Phosphatidylcholine und Sphingomyeline, bei denen die Phosphocholingruppe Bestandteil eines Lipids ist.[9] Daneben hat Phosphocholin Bedeutung für posttranslationale Modifikationen von Proteinen.[10]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Suxamethonium ist der Ester der Bernsteinsäure mit zwei Molekülen Cholin. Es wird in der Humanmedizin als Muskelrelaxans eingesetzt.[11]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Yves Dunant: Acetylcholine, a Ubiquitous Signalling Substance. Cambridge Scholars Publishing, 2021, ISBN 978-1-5275-6807-5, Introduction.
- ↑ Yves Dunant: Acetylcholine, a Ubiquitous Signalling Substance. Cambridge Scholars Publishing, 2021, ISBN 978-1-5275-6807-5, S. 2.
- ↑ Sarah Moreno, Stefanie Gerbig, Sabine Schulz, Bernhard Spengler, Martin Diener, Sandra Bader: Epithelial propionyl‐ and butyrylcholine as novel regulators of colonic ion transport. In: British Journal of Pharmacology. Band 173, Nr. 18, September 2016, S. 2766–2779, doi:10.1111/bph.13555, PMID 27423041, PMC 4995294 (freier Volltext).
- ↑ a b David Rudd, Maurizio Ronci, Martin R. Johnston, Taryn Guinan, Nicolas H. Voelcker, Kirsten Benkendorff: Mass spectrometry imaging reveals new biological roles for choline esters and Tyrian purple precursors in muricid molluscs. In: Scientific Reports. Band 5, Nr. 1, 1. September 2015, doi:10.1038/srep13408, PMID 26324173, PMC 4555103 (freier Volltext).
- ↑ Kirsten Benkendorff, David Rudd, Bijayalakshmi Nongmaithem, Lei Liu, Fiona Young, Vicki Edwards, Cathy Avila, Catherine Abbott: Are the Traditional Medical Uses of Muricidae Molluscs Substantiated by Their Pharmacological Properties and Bioactive Compounds? In: Marine Drugs. Band 13, Nr. 8, 18. August 2015, S. 5237–5275, doi:10.3390/md13085237, PMID 26295242, PMC 4557022 (freier Volltext).
- ↑ Giacomo Zaccone: Fish Defenses Vol. 2: Pathogens, Parasites and Predators. CRC Press, 2019, ISBN 978-1-4398-4285-0, S. 175.
- ↑ Kathleen Clauß, Alfred Baumert, Manfred Nimtz, Carsten Milkowski, Dieter Strack: Role of a GDSL lipase‐like protein as sinapine esterase in Brassicaceae. In: The Plant Journal. Band 53, Nr. 5, März 2008, S. 802–813, doi:10.1111/j.1365-313X.2007.03374.x.
- ↑ Maria Butzenlechner, Susanne Thimet, Klaus Kempe, Hugo Kexel, Hanns-Ludwig Schmidt: Inter- and intramolecular isotopic correlations in some cyanogenic glycosides and glucosinolates and their practical importance. In: Phytochemistry. Band 43, Nr. 3, Oktober 1996, S. 585–592, doi:10.1016/0031-9422(96)00290-7.
- ↑ Zheng Cui, Martin Houweling: Phosphatidylcholine and cell death. In: Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. Band 1585, Nr. 2-3, Dezember 2002, S. 87–96, doi:10.1016/S1388-1981(02)00328-1.
- ↑ Tristan M Lovell, Russell J Woods, David J Butlin, Kerensa J Brayley, Isaac T Manyonda, Jackie Jarvis, Steve Howell, Philip J Lowry: Identification of a novel mammalian post-translational modification, phosphocholine, on placental secretory polypeptides. In: Journal of Molecular Endocrinology. Band 39, Nr. 3, September 2007, S. 189–198, doi:10.1677/JME-07-0007, PMID 17766644, PMC 2189575 (freier Volltext).
- ↑ Emma L. Hartley, Roger Alcock: Rocuronium Versus Suxamethonium: A Survey of First-line Muscle Relaxant Use in UK Prehospital Rapid Sequence Induction. In: Prehospital and Disaster Medicine. Band 30, Nr. 2, April 2015, S. 184–186, doi:10.1017/S1049023X15000047.