Citrullin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Strukturformel von L-(+)-Citrullin, dem natürlich vorkommenden Enantiomer | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Citrullin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C6H13N3O3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer kristalliner Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 175,19 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
gut in Wasser (200 g·l−1 bei 20 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
L-(+)-Citrullin ist eine nicht-proteinogene α-Aminosäure, die von Pflanzen und Tieren produziert wird. Citrullin ist nach der Wassermelone (Citrullus vulgaris) benannt, in der es konzentriert enthalten ist. Es kommt entsprechend auch in anderen Kürbisgewächsen gehäuft vor.[4][5]
Citrullin ist ein Homologes von L-Homocitrullin,[6] das sich von L-Lysin durch Carbamoylierung ableitet.
Enantiomere[Bearbeiten | Quelltext bearbeiten]
Citrullin besitzt ein Stereozentrum, somit existieren zwei chirale Enantiomere.
Wenn in diesem Artikel oder in der wissenschaftlichen Literatur der Begriff „Citrullin“ ohne jeden Zusatz gebraucht wird, ist stets L-(+)-Citrullin gemeint.
| Enantiomere von Citrullin | ||
| Name | L-(+)-Citrullin | D-(–)-Citrullin |
| Andere Namen | (S)-Citrullin | (R)-Citrullin |
| Strukturformel | 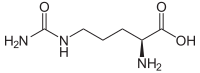 |

|
| CAS-Nummer | 372-75-8 | 13594-51-9 |
| 627-77-0 (Racemat) | ||
| EG-Nummer | 206-759-6 | – |
| 211-012-2 (Racemat) | ||
| ECHA-Infocard | 100.006.145 | – |
| 100.010.012 (Racemat) | ||
| PubChem | 9750 | 637599 |
| 833 (Racemat) | ||
| DrugBank | DB00155 | − |
| − (Racemat) | ||
| Wikidata | Q408641 | Q27077003 |
| Q27102910 (Racemat) | ||
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Es ist ein Zwischenprodukt des Harnstoffzyklus. Es entsteht normalerweise aus L-Ornithin und Carbamoylphosphat unter Abspaltung seines Phosphatrestes durch die Ornithin-Carbamoyl-Transferase. Es reagiert dann unter Spaltung von Adenosintriphosphat weiter mit L-Aspartat (Anion der Asparaginsäure) zu L-Argininosuccinat (Enzym: Argininosuccinat-Synthetase). Aspartat entsteht durch Transaminierung von Oxalacetat und schleust so eine der zwei für den produzierten Harnstoff benötigten Aminogruppen in den Harnstoffzyklus ein. Die andere stammt vom Carbamoylphosphat.
Physiologie[Bearbeiten | Quelltext bearbeiten]
Citrullin wird vom Menschen vermehrt mit dem Urin ausgeschieden, wenn er unter sogenanntem nitrosativen Stress leidet. Nitrosativer Stress ist eine endogene Belastung im Körper des Menschen durch das Stickstoffmonoxid-Radikal. Im Harnstoffzyklus reagiert dann vermehrt Arginin mit Sauerstoff. Diese Reaktion wird enzymatisch durch NO-Synthasen katalysiert. Über das Zwischenprodukt N-Hydroxyarginin entstehen Citrullin und Stickstoffmonoxid.[7] Daher wird Citrullin als Marker für nitrosativen Stress in der medizinischen Diagnostik benutzt.[8]
Citrullinierung[Bearbeiten | Quelltext bearbeiten]
Als Citrullinierung wird die enzymatische Umwandlung von Arginin in Citrullin bezeichnet. Peptidylarginin-Deiminasen (PAD) katalysieren diese posttranslationale Modifikation, die an bestimmten Proteinen und Peptiden stattfindet. Diese citrullinierten Proteine bzw. Peptide können vom Immunsystem als körperfremd angesehen und durch Antikörper angegriffen werden.[9] Citrullinierte Peptide spielen bei der Pathogenese der rheumatoiden Arthritis eine wichtige Rolle.[10][11]
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu CITRULLINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 22. Oktober 2021.
- ↑ a b c Eintrag zu L(+)-Citrulline bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- ↑ a b Datenblatt L-Citrulline, ≥98% (TLC) bei Sigma-Aldrich, abgerufen am 13. Februar 2013 (PDF).
- ↑ M. Wada: Über Citrullin, eine neue Aminosäure im Preßsaft der Wassermelone, Citrullus vulgaris schrad. In: Biochemische Zeitschrift. 1930, 224, S. 420–429.
- ↑ G. Klein (Herausgeber, Autor) Handbuch der Pflanzenanalyse, vierter Band/ erste Hälfte, spezielle Analyse, dritter Teil, organische Stoffe III – besondere Methoden – Tabellen, 1933, 840, Springer-Verlag, 2. Juli 2013. S. 61–62.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu L-Homocitrullin: CAS-Nummer: 1190-49-4, EG-Nummer: 214-722-0, ECHA-InfoCard: 100.013.384, PubChem: 65072, ChemSpider: 58582, Wikidata: Q18207833.
- ↑ Rassow, Hauser, Netzker, Deutzmann: Biochemie, 3. Auflage, Thieme-Verlagsgruppe, ISBN 978-3-13-125353-8, S. 633.
- ↑ Bodo Kuklinski: Das HWS-Trauma, Aurum Verlag, 2006.
- ↑ P. Migliorini, F. Pratesi u. a.: The immune response to citrullinated antigens in autoimmune diseases. In: Autoimmunity Reviews. Band 4, Nummer 8, November 2005, S. 561–564, doi:10.1016/j.autrev.2005.04.007, PMID 16214096 (Review).
- ↑ R. Yamada, A. Suzuki u. a.: Citrullinated proteins in rheumatoid arthritis. In: Frontiers in bioscience : a journal and virtual library. Band 10, Januar 2005, S. 54–64, PMID 15574347 (Review).
- ↑ T. Gazitt, C. Lood, K. B. Elkon: Citrullination in Rheumatoid Arthritis-A Process Promoted by Neutrophil Lysis? In: Rambam Maimonides medical journal. Band 7, Nummer 4, Oktober 2016, S. , doi:10.5041/RMMJ.10254, PMID 27824546, PMC 5101001 (freier Volltext) (Review).