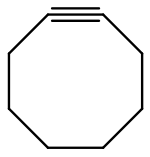
Cyclooctin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Cyclooctin | ||||||||||||
| Andere Namen |
1-Cyclooctin | ||||||||||||
| Summenformel | C8H12 | ||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 108,18 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||
| Dichte |
0,868 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt | |||||||||||||
| Löslichkeit |
löslich in Tetrahydrofuran, Acetonitril, Diethylether, n-Pentan und den meisten organischen Lösungsmitteln[1] | ||||||||||||
| Brechungsindex |
1,4850 (20 °C)[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||
Cyclooctin ist eine chemische Verbindung aus der Gruppe der cyclischen Alkine. Sie ist der kleinste Ring in der Klasse der Cycloalkine, der in reiner Form isolierbar ist.[1]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Cyclooctin wurde erstmals durch Oxidation von 1,2-Cyclooctandiondihydrazon von Alfred Theodore Blomquist[4] and Liang Huang Liu im Jahr 1953 synthetisiert.[5]
Später wurde auch eine Synthesen ausgehend von 1-Bromcycloocten[6] entwickelt, die im Gegensatz zur ersten Synthese die Bildung von isomerem 1,2-Cyclooctadien[7] vermeidet.[8] So erhält man Cyclooctin aus 1-Bromcycloocten durch die Eliminierung von HBr mit Natriumamid, sowie durch Oxydation von 1-Amino-4.5.6.7.8.9-hexahydro-cyclooctatriazol mit Bleitetraacetat.[9]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Cyclooctin ist eine farblose Flüssigkeit, die löslich in den meisten organischen Lösungsmitteln ist. Die Verbindung ist bekannt für ihre beträchtliche Ringspannung (etwa 20 kcal/mol). Diese Eigenschaft macht Cyclooctin sowohl aus synthetischer als auch aus theoretischer Sicht interessant. Die ersten untersuchten Reaktionen von Cyclooctin waren Cycloadditionen, darunter eine [2+2+2]-Cyclotrimerisierung, eine [3+2]-Huisgen-1,3-dipolare Cycloaddition bzw. eine [4+2]-Diels-Alder-Reaktion.[1] Cyclooctin weist eine verdrehte CC-Dreifachbindung auf.[10] Der Bindungswinkel an der verzerrten Kohlenstoff-Kohlenstoff-Dreifachbindung beträgt dabei etwa 160°.[8]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Cyclooctin ist eine hochreaktive Verbindung die einen vielseitigen Baustein in der organischen Synthese darstellt. Zum Beispiel für 1,3-dipolare Cycloadditionen und Diels-Alder Reaktionen.[8] Die Verbindung wird auch als Reagenz in Cycloadditionen für die kupferfreie Click-Chemie verwendet.[1]
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i Trevor Harris, Igor V. Alabugin: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, Chichester, UK 2017, ISBN 978-0-470-84289-8, Cyclooctyne, S. 1–3, doi:10.1002/047084289x.rn02079.
- ↑ a b G.W.A. Milne: Handbook of Data on Common Organic Compounds. CRC-Press, 1995, ISBN 978-0-8493-0404-0, S. 924 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Cornell University: Blomquist, Alfred Theodore, abgerufen am 24. September 2023.
- ↑ A. T. Blomquist, Liang Huang Liu: Many-membered Carbon Rings. VII. Cycloöctyne. In: Journal of the American Chemical Society. Band 75, Nr. 9, 1953, S. 2153–2154, doi:10.1021/ja01105a039.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 1-Bromcycloocten: CAS-Nummer: 61815-42-7, PubChem: 5365716, ChemSpider: 4517672, Wikidata: Q122827998.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 1,2-Cyclooctadien: CAS-Nummer: 7124-40-5, ECHA-InfoCard: 100.295.354, PubChem: 572661, Wikidata: Q82111500.
- ↑ a b c Dieter Heber, Peter Rösner, Werner Tochtermann: Cyclooctyne and 4‐Cyclooctyn‐1‐ol – Versatile Building Blocks in Organic Synthesis. In: European Journal of Organic Chemistry. Band 2005, Nr. 20, 2005, S. 4231–4247, doi:10.1002/ejoc.200500288.
- ↑ Georg Wittig, Hans-Lothar Dorsch: Zur Existenz niedergliedriger Cycloalkine, VIII Zur Bildung und Reaktivität von Cyclooctin. In: Justus Liebigs Annalen der Chemie. Band 711, Nr. 1, 1968, S. 46–54, doi:10.1002/jlac.19687110108 (wiley.com).
- ↑ M. Trætteberg, W. Lüttke, R. Machinek, A. Krebs, H. J. Hohlt: Cyclooctyne — a sterically strained molecule with an unusual CC triple bond geometry. In: Journal of Molecular Structure. Band 128, Nr. 1, 1985, S. 217–232, doi:10.1016/0022-2860(85)85053-5.