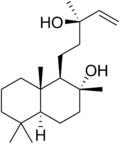
Galanolakton
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Galanolakton | ||||||||||||
| Andere Namen |
(3E)-3-{2-[(1R,2S,4aS,8aS)-5,5,8a-Trimethyloctahydro-1H-spiro[naphthalene-2,2'-oxiran]-1-yl]ethyliden}dihydro-2(3H)-furanon (IUPAC) | ||||||||||||
| Summenformel | C20H30O3 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 318,45 g·mol−1 | ||||||||||||
| Schmelzpunkt |
125–126 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Galanolakton ist ein aus Ingwer und Alpina Galanga gewonnener Naturstoff der Klasse Diterpene und wirkt antagonistisch auf 5-HT-Rezeptoren[3].
Synthese
[Bearbeiten | Quelltext bearbeiten]Eine Partialsynthese von 1997 geht vom Naturstoff (−)-Sclareol aus.[4] Im ersten Schritt der Synthese wird durch einen Überschuss des Katalysators OsO4 die endständige Doppelbindung gespalten und durch Oxidation entsteht, als erstes Zwischenprodukt, ein Keton. Dieses Zwischenprodukt reagiert durch Addition und Eliminierung zu einer cyclischen Verbindung. Die entstandene Doppelbindung wird durch die Addition des Katalysators aufgebrochen und nach der Abspaltung des Katalysators entstehen zwei neue Doppelbindungen. Es wird eine Aldehydgruppe gebildet und eine Essigsäuregruppe.

Der nächste Schritt ist eine Wittig-Horner-Reaktion. Die Aldehydgruppe reagiert zu zwei Lakton-Isomeren. Das (E)-Isomer wird mit einer Ausbeute von 67 % erhalten und kann säulenchromatographisch vom (Z)-Isomer getrennt werden.
Dieses reagiert weiter mit Chinolin unter Eliminierung (E1cB) von der Essigsäure. Chinolin greift die Methylgruppe an und deprotoniert diese, weswegen sich die Essigsäure durch intramolekularen Protonenverschiebung abspalten kann und eine Doppelbindung gebildet werden kann.

Der letzte Schritt der Galanolakton-Synthese ist die Epoxidierung an der Doppelbindung, die im vorherigen Schritt entstanden ist. Dieser Reaktionsschritt wird auch Prileschajew-Reaktion genannt, wofür meta-Chlorperbenzoesäure (mCPBA) als Katalysator verwendet wird. Der Angriff kann von zwei Seiten erfolgen, wodurch zwei Isomere entstehen mit unterschiedlichen Konfigurationen des Epoxids.

Zunächst entsteht mit 45 % das Hauptprodukt (–)-8-epi-Galanolakton und das natürliche Galanolakton kann nicht nachgewiesen werden. Dennoch entsteht nach verlängerter Reaktionszeit auch das natürliche Galanolakton zu einem Verhältnis von 1:3.
Bioaktivität
[Bearbeiten | Quelltext bearbeiten]5-HT-Rezeptor Antagonist
Von wichtiger Bedeutung ist die Wirkung von Galanolakton als Antagonist auf 5-HT-(Serotonin-)Rezeptoren.[3] Diese Rezeptoren sind im Zentralen Nervensystem und im Magen-Darm-Trakt lokalisiert und sind unter anderem bedeutsam bei Lernprozessen und Gedächtnisleistung, sowie bei Migräne, Depression, Übelkeit und Erbrechen.
Die antagonistische Wirkung führt zu einer Umkehr der auslösenden Wirkung der Rezeptoren und somit zu einer anti-emetischen, also Brechreiz-unterdrückenden, sowie Magen-Darm-Motilitätssteigernden Wirkung.[5]
Die Aktivität an den 5-HT-Rezeptoren (Untergruppe 5-HT3) steht außerdem in Verbindung mit der Gedächtnisleistung und Lernprozessen.[6] Acetylcholin fördert die Gedächtnisleistung und eine Freisetzung wird durch 5-HT3-Rezeptor Antagonisten begünstigt. Studie 7 untersucht den Effekt von Galanolakton auf die kognitiven Fähigkeiten an Mäusen. Dazu verabreicht man ihnen Scopolamin und/oder Diazepam, dessen Wirkung (acetylcholinhemmend) und kognitive Veränderung als Modell für Alzheimer gilt. Eine darauffolgende Verabreichung von Galanolakton führt zu einer Umkehrung der Wirkung, durch eine Verminderung der Aktivität des Enzyms Acetylcholinesterase, ausgelöst durch die Wirkung von Galanolakton als 5-HT3-Rezeptor Antagonist, woraus eine Verbesserung des Arbeits- sowie Langzeitgedächtnisses abzuleiten sind.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Shmuel Yannai: Dictionary of Food Compounds with CD-ROM. CRC Press, 2012, ISBN 978-1-4200-8352-1, S. 655.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Huang QR, Iwamoto M, Aoki S, Tanaka N, Tajima K, Yamahara J, Takaishi Y, Yoshida M, Tomimatsu T, Tamai Y: Anti-5-hydroxytryptamine3 effect of galanolactone, diterpenoid isolated from ginger. In: Chemical and Pharmaceutical Bulletin. Band 39, Nr. 2. Chem Pharm Bull (Tokyo), 1991, S. 397–399, doi:10.1248/cpb.39.397.
- ↑ Mankil Jung, Seakioon lee, Byunghee Yoon: Conversion of Sclareol (+)-Galanolactone and (+)-Labdienedial. In: Tetrahedron Letters. Band 38, Nr. 16, 1997, S. 2871–2874, doi:10.1016/S0040-4039(97)00485-1.
- ↑ Siregar, Rahmad S.; Hadiguna, Rika A.; Kamil, Insanul; Nazir, Novizar; Nofialdi, Nofialdi: Ginger (Zingiber officinale R.) as a Potent Medicinal Plant for the Prevention and Treatment of Diabetes Mellitus: A Review. In: Tropical Journal of Natural Product Research. Band 6, Nr. 4, 2022, S. 462–469 (researchgate.net [PDF]).
- ↑ Pal, Abhisek; Sahu, Pratap K.; Juadi, Sanjukta; Swain, Truptirekha: Effect of Galanolactone on Learning and memory: A study on role of Serotonin. Hrsg.: Pharmacologyonline. S. 102–111.