Osmium(VIII)-oxid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| _ Os8+ _ O2− | ||||||||||||||||
| Kristallsystem |
monoklin | |||||||||||||||
| Raumgruppe |
C2/c (Nr. 15) | |||||||||||||||
| Gitterparameter |
a = 938 pm, b = 452 pm, c = 863 pm, β = 116,58° | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Osmium(VIII)-oxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | OsO4 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 254,23 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
4,91 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
130 °C[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 0,2 μl·m−3 bzw. 2 μg·m−3 (berechnet als Osmium)[5] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−386 kJ·mol−1[6] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Osmium(VIII)-oxid (auch: Osmiumsäure) ist das Oxid des Elementes Osmium in seinem höchsten Oxidationszustand (+8).
Darstellung und Gewinnung[Bearbeiten | Quelltext bearbeiten]
Osmium(VIII)-oxid wird durch Oxidation aus Osmium oder von Osmiumlösungen mit Salpetersäure oder Natriumperoxodisulfat in Schwefelsäure hergestellt. Wegen seiner Flüchtigkeit und Giftigkeit kommt es in Ampullen eingeschmolzen in den Handel.

Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Physikalische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Osmium(VIII)-oxid bildet blassgelbe Kristalle mit einem sehr niedrigen Schmelzpunkt von 40 °C und einem Siedepunkt von 130 °C. Diese Verbindung besitzt einen durchdringenden ozonähnlichen Geruch (altgriechisch ὀσμή osmē „Geruch, Gestank“), was die Namensgebung für das Metall Osmium erklärt. Osmium(VIII)-oxid besitzt eine monokline Kristallstruktur mit der Raumgruppe C2/c (Raumgruppen-Nr. 15). Die Gitterparameter sind a = 938 pm, b = 452 pm, c = 863 pm und β = 116,58°.[7] Es löst sich nur mäßig in Wasser, jedoch sehr gut in Tetrachlorkohlenstoff CCl4.
Chemische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Osmium(VIII)-oxid ist ein starkes Oxidationsmittel und reagiert mit reduzierenden und brennbaren Stoffen. Es wird leicht durch organische Verbindungen zu schwarzem Osmium(IV)-oxid reduziert.
Verwendung[Bearbeiten | Quelltext bearbeiten]
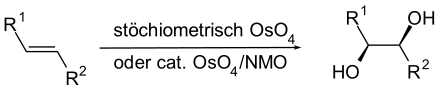
In der organischen Synthese kann es verwendet werden, um Alkene zu Diolen zu oxidieren (Dihydroxylierung). Dabei entsteht stereoselektiv ein Diol mit cis-ständigen OH-Gruppen. Da das Reagens sehr teuer und giftig ist, wurden die Reaktionsbedingungen inzwischen so verbessert, dass Osmium(VIII)-oxid nur in kleinen Mengen als Katalysator erforderlich ist, während Wasserstoffperoxid oder N-Methylmorpholin-N-oxid als Oxidationsmittel wirken.[8]
Für die Transmissionselektronenmikroskopie (TEM) wird typisch 1%ige[9] Osmiumtetroxidlösung zum Nachfixieren und Kontrastieren von Proben aus biologischem Material verwendet. Insbesondere Lipide werden dabei optisch schwarz angefärbt.
Sonstiges[Bearbeiten | Quelltext bearbeiten]
Am 6. April 2004 berichtete die amerikanische Nachrichtenagentur ABC News, dass der britische Geheimdienst glaubte, einen Bombenanschlag unter Verwendung dieser Substanz vereitelt zu haben. Andere Quellen bezweifeln diese Darstellung, da Osmium(VIII)-oxid trotz seines hohen Schadenspotenzials für die Verwendung als Giftgas zu teuer sei.
Am 27. Mai 2011 ereignete sich ein Unfall an der Universitätsklinik Magdeburg: Eine Flasche mit 20–50 ml 2-%-Osmiumtetroxid-Lösung ging zu Bruch. Personen kamen dadurch nicht zu Schaden, das Haus 1 musste jedoch teilweise evakuiert werden. Die Feuerwehr reinigte den Unfallort.[10]
Literatur[Bearbeiten | Quelltext bearbeiten]
- Daniela Pelclova: Osmium. In: Handbook on the Toxicology of Metals. Elsevier, 2022, ISBN 978-0-12-822946-0, S. 639–647, doi:10.1016/b978-0-12-822946-0.00023-4.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Eintrag zu Osmiumtetroxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 18. Juli 2011.
- ↑ a b c d e Eintrag zu Osmium(VIII)-oxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b c d e f Datenblatt Osmium(VIII)-oxid bei Merck, abgerufen am 19. Januar 2011.
- ↑ Eintrag zu Osmium tetraoxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 20816-12-0 bzw. Osmium(VIII)-oxid), abgerufen am 2. November 2015.
- ↑ A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 2. Band: Nebengruppenelemente, Lanthanoide, Actinoide, Transactinoide. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049590-4, S. 1975 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ B. Krebs, K. Hasse: Refinements of the crystal structures of KTcO4, KReO4 and OsO4. Bond lengths in tetrahedral oxo-anions and oxides of d0 transition metals. In: Acta Crystallographica Section B. Band 32, 1976, S. 1334–1337, doi:10.1107/S056774087600530X.
- ↑ V. VanRheenen, D.Y. Cha, W.M. Hartley: Catalytic Osmium Tetroxide Oxidation of Olefins: cis-1,2-Cyclohexanediol In: Organic Syntheses. 58, 1978, S. 43, doi:10.15227/orgsyn.058.0043; Coll. Vol. 6, 1988, S. 342 (PDF).
- ↑ Eva-Maria Rottmayr: Licht- und elektronenmikroskopische Untersuchungen der Tunika von Cystodytes dellechiajei DELLA VALLE. Dissertation, München 2001, S. 28.
- ↑ Uni Magdeburg (Hrsg.): UMMD – intern. Fakultätsratsinfo. Nr. 5, 2011 (uni-magdeburg.de [PDF; 763 kB; abgerufen am 21. Mai 2016]).

