Iodtrichlorid
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
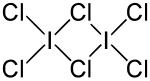
| ||||||||||
| Allgemeines | ||||||||||
| Name | Iodtrichlorid | |||||||||
| Summenformel |
| |||||||||
| Kurzbeschreibung |
rotbraune Kristalle mit stechendem Geruch[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 233,26 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
3,12 g·cm−3 [1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
77 °C (Zersetzung) [2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Iodtrichlorid ist eine ätzende Interhalogenverbindung, die aus Iod und Chlor besteht. Es wurde 1814 von Humphry Davy dargestellt.[3]
Gewinnung und Darstellung
Iodtrichlorid entsteht, wenn man Chlor auf Iodchlorid einwirken lässt.[2]
Eigenschaften

Iodtrichlorid bildet im Unterschied anderer Interhalogene Dimere, (ICl3)2. Dabei sind die Bindungswinkel sowie die Bindungslängen nicht identisch (vgl. obere Abbildung).[3]
Iodtrichlorid riecht stechend und bildet gelbe Nadeln, die an der Luft zerfließen. Es lässt sich gut in Alkohol, Ether und Benzol lösen.[2]
Mit Wasser reagiert Iodtrichlorid zu Iodchlorid, Salzsäure und Iodsäure.[3]
Verwendung
Iodtrichlorid kann man in der präparativen organischen Chemie sowohl zur Iodierung als auch zur Chlorierung, beispielsweise zur Chlorierungen von Aromaten, einsetzen.[2]
Einzelnachweise
- ↑ a b c d e f Datenblatt Iodtrichlorid bei Merck
- ↑ a b c d Dr. Bernd Dill (Hrsg.), Prof. Dr. Fred Robert Heiker (Hrsg.), Prof. Dr. Andreas Kirschning (Hrsg.): Römpp Chemie Lexikon. 9. Auflage, Band 3, Georg Thieme Verlag, 1992 ISBN 978-3137348092 Seite 2019.
- ↑ a b c Nils Wiberg, Egon Wiberg und Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. Gruyter Verlag; 102., stark umgearb. u. verb. Auflage 2007; ISBN 978-3-11-017770-1; S. 459ff.



