Norbornen
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Norbornen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C7H10 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff mit säuerlichem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 94,15 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
0,87 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
95–96 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
sehr schwer in Wasser (0,13 g·l−1 bei 20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Norbornen, auch Norbornylen oder Norcamphen, sind Trivialnamen für einen verbrückten, bicyclischen Kohlenwasserstoff. Bei Raumtemperatur liegt Norbornen als weißer, stechend riechender Feststoff vor. Das Molekül besteht aus einem Cyclohexen-Ring, der mit einer Methylengruppe 1,4-verbrückt ist. Die Doppelbindung führt zu einer Ringspannung und ist für die erhöhte Reaktivität des Moleküls mitverantwortlich.
Mit Wasser reagiert Norbornen in einer säurekatalysierten Reaktion zu Norborneol. Diese Reaktion ist für Chemiker von Interesse, die sich mit nichtklassischen Ionen beschäftigen.[3]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Norbornen wird aus Cyclopentadien und Ethen in einer Diels-Alder-Reaktion hergestellt, ähnlich wie auch viele seiner Derivate.[4][5]

Verwandte bicyclische Verbindungen mit demselben Kohlenstoffgerüst sind Norbornadien, das eine weitere Doppelbindung besitzt, und Norbornan ohne Doppelbindungen (gesättigt).
Polynorbornene
[Bearbeiten | Quelltext bearbeiten]Norbornene sind wichtige Monomere, die unter Einwirkung von Grubbs-Katalysatoren (zumeist Carbenkomplexe des Rutheniums) in ROMP-Reaktionen (ring-opening metathesis polymerization, also Ringöffnungsmetathesepolymerisation; siehe auch Metathese) polymerisieren. Unter anderen Bedingungen sind abweichende Polymerisationsreaktionen möglich.
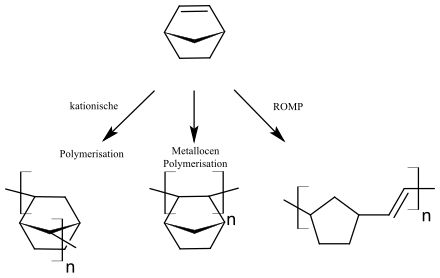
Polynorbornene sind Polymere, die sich durch hohe Glasübergangstemperaturen und hohe optische Klarheit auszeichnen.
Außer in ROMP-Reaktionen können Norbornen-Monomere auch durch Vinyladdition-Polymerisationen polymerisieren.
Ethyliden-Norbornen ist ein verwandtes Monomer, das sich von Cyclopentadien und Butadien ableitet.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Norbornen dient als Ausgangsmaterial für pharmazeutische Zwischenprodukte, Pestizide, künstliche Duftstoffe und der allgemeinen organischen Synthese. In Kombination mit Ethen kann Norbornen zu einem Cyclo-Olefin-Copolymer umgesetzt werden.
Literatur
[Bearbeiten | Quelltext bearbeiten]- IUPAC – Nomenclature of Organic Chemistry, Sections A-H, Pergamon Press, 1979, S. 49, 498
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Norbornen bei Merck, abgerufen am 16. April 2011.
- ↑ a b c d Eintrag zu 2-Norbornen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- ↑ F. Scholz, D. Himmel, F. W. Heinemann, P. v. R. Schleyer, K. Meyer, I. Krossing: Crystal Structure Determination of the Nonclassical 2-Norbornyl Cation. In: Science. 341, 2013, S. 62–64, doi:10.1126/science.1238849.
- ↑ Paul Binger, Petra Wedemann, Udo H. Brinker: Cyclopropene: A New Simple Synthesis And Its Diels-Alder Reaction With Cyclopentadiene In: Organic Syntheses. 77, 2000, S. 254, doi:10.15227/orgsyn.077.0254; Coll. Vol. 10, 2004, S. 231 (PDF).
- ↑ Masaji Oda, Takeshi Kawase, Tomoaki Okada, Tetsuya Enomoto: 2-Cyclohexene-1,4-Dione In: Organic Syntheses. 73, 1996, S. 253, doi:10.15227/orgsyn.073.0253; Coll. Vol. 9, 1998, S. 186 (PDF).


