Phellogensäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Phellogensäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C22H44O3 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 370,57 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
0,9480 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser, löslich in Tetrahydrofuran[6] und Diethylether[7] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
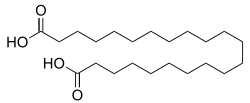
Phellogensäure oder chemisch 1,22-Docosandisäure ist eine chemische Verbindung aus der Gruppe der α,ω-Dicarbonsäuren.[8]
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Die Phellogensäure kommt in der Natur in Kork[9] und Japanwachs[10] vor.[5]
Herstellung[Bearbeiten | Quelltext bearbeiten]
Ein Standardverfahren zur Herstellung von Docosandisäure[1] bedient sich der generellen Methode zur Verlängerung der Kettenlänge von Carbonsäuren um sechs bzw. von Dicarbonsäuren um zwölf Kohlenstoffatome durch einfache bzw. bei Dicarbonsäuren doppelte Umsetzung der entsprechenden Säurechloride mit dem cyclischen Enamin 1-Morpholino-1-cyclohexen und anschließende Wolff-Kishner-Reduktion der als Zwischenprodukt anfallenden 7,16-Diketodocosansäure.[11]
Analog kann mit 1-Morpholino-1-cyclopenten eine Verlängerung um fünf bzw. zehn Kohlenstoffatome erzielt werden.[12]

Die weiteren in der Monographie der Organic Syntheses[1] angeführten älteren Synthesewege zu Docosandisäure sind bezüglich Ausgangsmaterialien und Prozessbedingungen aufwendig und wenig ergiebig, wie z. B. die erwähnte Reaktion von α,ω-Diiodeicosan mit Kaliumcyanid und Hydrolyse des gebildeten Dinitrils.
Den besten Zugang zu 1,22-Docosandisäure bietet die mit Kupfer(I)-chlorid katalysierte oxidative Kupplung von 10-Undecinsäure zur 10,12-Docosadiin-1,22-disäure mit einer Ausbeute von 90 % d.Th. und deren praktisch quantitative katalytische Hydrierung zur Titelverbindung.[4]
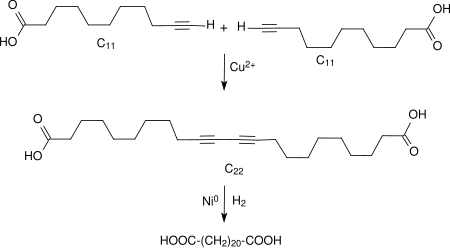
Die Ausgangsverbindung 10-Undecinsäure ist über die aus Rizinusöl preisgünstig erhältliche 10-Undecensäure relativ einfach zugänglich.
Biochemisch entsteht Docosandisäure bei der ω-Oxidation von n-Docosansäure (Behensäure) in den Mikrosomen aus Rattenleberzellen über die Zwischenstufe 22-Hydroxydocosansäure.[13]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
1,22-Docosadisäure bildet beim Umkristallisieren aus Methanol feine farblose Kristallnädelchen[4] mit wachsartiger Konsistenz. Mit seiner langen C20-Kohlenwasserstoffkette zwischen den beiden funktionellen Endgruppen stellt 1,22-Docosadisäure einen ausgeprägt hydrophoben Spacer (Abstandshalter) für chemische und biochemische Konjugate dar.
Anwendungen[Bearbeiten | Quelltext bearbeiten]
Eine solche Anwendung der Docosandisäure als hydrophober Spacer zwischen zwei 17β-Estradiol-Einheiten führt zu Estradioldimeren mit hoher Bindungsstärke an spezifische Estrogenrezeptoren (Erα).[14]
Phellogensäure natürlichen Ursprungs aus Strandflieder (Limonium sp.) wirkt als Inhibitor für das Enzym Tyrosinphosphatase (PTP1B), das einen wichtigen negativen Regulator für den Insulinrezeptor darstellt.[15]
Durch Reaktion z. B. mit N-Hydroxysuccinimid unter geeigneten Bedingungen[6] wird ein monosubstituierter Imidester (Aktivester bzw. NHS-Ester) der Docosandisäure erhalten, der zur Modifizierung von Enzymen eingesetzt wird und die Plasmahalbwertszeiten der so derivatisierten biologisch aktiven Proteine verlängert und ihre Antigenität verringert.

Grenzflächenaktive Verbindungen des Molekültyps A-B-A werden durch Umsetzung der aktivierten Carboxylendgruppen von Docosandisäure (Baustein A) mit Monomethoxy-polyethylenglycolen (Bausteine B) erhalten,
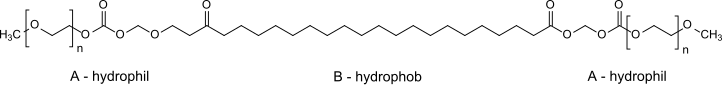
denen Brauchbarkeit als Lösungsvermittler, Netzmittel und Einbettungsmaterial zur Wirkstoffabgabe zugeschrieben wird.[16]
Docosandisäure kann zur Stabilisierung durch Vernetzung und Hydrophobierung von Mikropartikeln mit einer bioabbaubaren Matrix aus Stärke, die (zusammen mit Gas) als Ultraschallkontrastmittel Verwendung finden.[7]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d S. Hünig, E. Lücke, W. Brenninger: Docosanedioic Acid In: Organic Syntheses. 43, 1963, S. 34, doi:10.15227/orgsyn.043.0034; Coll. Vol. 5, 1973, S. 533 (PDF).
- ↑ a b c d Datenblatt Docosanedioic acid, 85% bei Sigma-Aldrich, abgerufen am 27. Oktober 2014 (PDF).
- ↑ Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons. Elsevier, 2014, ISBN 978-0-323-28659-6, S. 343.
- ↑ a b c Artur Seher: Die Konstitution der Isan- und Isanolsäure. In: Liebigs Ann. Chem. Band 589, Nr. 3, 30. Oktober 1954, S. 222–238, doi:10.1002/jlac.19545890308.
- ↑ a b Eintrag zu Japanwachs. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. Oktober 2014.
- ↑ a b Patent EP0511600: Long chain carboxylic acid imide ester. Angemeldet am 24. April 1992, veröffentlicht am 4. November 1992, Anmelder: Kuraray Co., Ltd., Erfinder: I. Ebashi, T. Takigawa, M. Inoue.
- ↑ a b Patent US5558857: Contrast agents. Angemeldet am 3. Juni 1992, veröffentlicht am 24. September 1996, Anmelder: Nycomed Imaging AS, Erfinder: J. Klaveness, P. Rongved, P. Strande.
- ↑ Fritz Zetzsche, Moritz Bähler: Untersuchungen Über den Kork VII. Phellogensäure (Beitrag zum Verhalten der α-Oxysäuren in der Kalischmelze). In: Helv. Chim. Acta. Band 14, Nr. 4, 1. Juli 1931, S. 852–856, doi:10.1002/hlca.19310140425.
- ↑ M.C. Garcia-Vallejo, E. Conde, E. Cadahia, B. Fernández de Simón: Suberin composition of reproduction cork from Quercus suber. In: Holzforschung. Band 51, Nr. 3, 2009, S. 219–224, doi:10.1515/hfsg.1997.51.3.219.
- ↑ Patent EP0974338: Pflegende kosmetische und dermatologische Zubereitungen mit einem Gehalt an Fettsäuren. Angemeldet am 13. Juli 1999, veröffentlicht am 26. Januar 2000, Anmelder: Beiersdorf AG, Erfinder: G. Lanzendörfer, V. Schreiner, G. Schneider, F. Wolf.
- ↑ S. Hünig, E. Lücke, W. Brenninger: 1-Morpholino-1-cyclohexene In: Organic Syntheses. 41, 1961, S. 65, doi:10.15227/orgsyn.041.0065; Coll. Vol. 5, 1973, S. 808 (PDF).
- ↑ E.D. Bergmann, R. Ikan: 6-Phenylazulene. In: J. Am. Chem. Soc. Band 78, Nr. 7, 1956, S. 1482–1485, doi:10.1021/ja01588a056.
- ↑ R.J. Sanders, R. Ofman, F. Valianpour, S. Kemp, R.J. Wanders: Evidence for two enzymatic pathways for omega-oxidation of docosanoic acid in rat liver microsomes. In: J. Lipid Res. Band 46, Nr. 5, 2005, S. 1001–1008, doi:10.1194/jlr.M400510-JLR200.
- ↑ A. E. Wendlandt, S. M. Yelton, D. Lou, D. S. Watt, D. J. Noonan: Synthesis and functional analysis of novel bivalent estrogens. In: Steroids. Band 75, Nr. 12, 2010, S. 825–833, doi:10.1016/j.steroids.2010.05.019.
- ↑ Baumgartner: Virtual and Real Screening of Natural Products to Find Effective Modulators of Protein Tyrosine Phosphatase PTP1B. In: Scientia Pharmaceutica. 77, 2009, S. 199–199, doi:10.3797/scipharm.oephg.21.SL-32.
- ↑ J. Arukwe, B. Balinov, G. Hagelin, H. Dugstad, T. Thomassen: Synthesis and characterization of new monomethoxypoly (ethylene glycol) (mPEG) carbonate ester surfactants. In: Acta Chem. Scand. Band 53, 1999, S. 594–601 (PDF).
