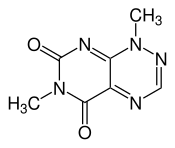
Toxoflavin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Toxoflavin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H7N5O2 | ||||||||||||||||||
| Kurzbeschreibung |
dunkelgelber Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 193,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser (10 g·l−1)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Toxoflavin (Trivialname, oft als PKF118-310 bezeichnet) ist ein Alkaloid mit einer 7-Azapteridin-Grundstruktur. Es ist im Vergleich zur Grundstruktur von der es sich ableitet zweifach an Stickstoffatomen methyliert und zweifach an Kohlenstoffatomen oxidiert. Der Trivialname ist irreführend, da es sich nicht um ein Flavin handelt. Vielmehr ähnelt es dem Reumycin,[2] welches auch als Demethyltoxoflavin bezeichnet wird. Toxoflavin gehört zu den Pan-Assay Interference Compounds (PAINS). Seine Wirkung als Phytotoxin beruht auf dessen Eigenschaft, reversibel reduzierbar zu sein. Es kann daher unter physiologischen Bedingungen Wasserstoffperoxid bilden.[3]
Geschichte[Bearbeiten | Quelltext bearbeiten]
Toxoflavin wurde zuerst 1934 von den niederländischen Forschern van Veen und Mertens beschrieben, die es als gelbe, kristalline Substanz aus Pseudomonas cocovenenans isolierten.[4] Es wurde damals für schwere Lebensmittelvergiftungen auf Java verantwortlich gemacht. Die erste Synthese wurde 1961 von G. D. Daves Junior, R. K. Robins und C. C. Cheng publiziert.[5] Diese verwendeten als Edukt Thiobarbitursäure, welche am Schwefelatom und an einem der Stickstoffatome durch Dimethylsulfat methyliert wird. Durch Phosphoroxytrichlorid lässt sich die gegenüberliegende Hydroxygruppe selektiv mit einem Chloratom substituieren. Das Methylthiolat wird sauer hydrolysiert und die verbleibende unsubstituierte Position im Ring nitriert. Nach Reduktion der Nitrogruppe wird das erhaltene Amin mit dem gekreuzten Anhydrid der Essigsäure und der Ameisensäure formyliert und anschließend mit Methylhydrazin cyclokondensiert. Der so gewonnene Vorläufer wird zum Endprodukt oxidiert.

Vorkommen[Bearbeiten | Quelltext bearbeiten]
Toxoflavin kommt in Bodenbakterien der Arten Burkholderia glumae und Streptomyces hiroshimensis vor.[6][7]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Das inzwischen kommerziell leicht zugängliche 6-Chlor-3-methyluracil[8] sorgt als Edukt in modernen Synthesen von Toxoflavin für eine deutliche Verkürzung der Arbeitsschritte. Zunächst wird das Chloratom durch Methylhydrazin substituiert. Die Anellierung des zweiten Ringes erfolgt dann durch Umsetzung mit Formaldehyd und Natriumnitrit in einer Ein-Topf-Reaktion.[9]

Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Toxoflavin hat einen Octanol-Wasser-Verteilungskoeffizient von .[1]
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f Datenblatt PKF118-310 bei Sigma-Aldrich, abgerufen am 3. November 2023 (PDF).
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Reumycin: CAS-Nummer: 5016-18-2, PubChem: 5351216, ChemSpider: 4508266, Wikidata: Q9068429.
- ↑ Payal Rana, Russell Naven, Arjun Narayanan, Yvonne Will, Lyn H. Jones: Chemical motifs that redox cycle and their associated toxicity. In: MedChemComm. Band 4, Nr. 8, 2013, S. 1175, doi:10.1039/c3md00149k.
- ↑ K. G. Stern: Oxidation-reduction potentials of toxoflavin. In: The Biochemical journal. Band 29, Nummer 2, Februar 1935, S. 500–508, doi:10.1042/bj0290500, PMID 16745691, PMC 1266509 (freier Volltext).
- ↑ G. D. Daves, R. K. Robins, C. C. Cheng: THE TOTAL SYNTHESIS OF TOXOFLAVIN. In: Journal of the American Chemical Society. Band 83, Nr. 18, September 1961, S. 3904–3905, doi:10.1021/ja01479a041.
- ↑ F. Suzuki, H. Sawada, K. Azegami, K. Tsuchiya: Molecular characterization of the tox operon involved in toxoflavin biosynthesis of Burkholderia glumae. In: Journal of General Plant Pathology. Band 70, Nr. 2, 1. April 2004, S. 97–107, doi:10.1007/s10327-003-0096-1.
- ↑ C. Su, Y. Yan, X. Guo, J. Luo, C. Liu, Z. Zhang, W.-S. Xiang, S.-X. Huang: Characterization of the N -methyltransferases involved in the biosynthesis of toxoflavin, fervenulin and reumycin from Streptomyces hiroshimensis ATCC53615. In: Organic & Biomolecular Chemistry. Band 17, Nr. 3, 2019, S. 477–481, doi:10.1039/C8OB02847H.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 6-Chlor-3-methyluracil: CAS-Nummer: 4318-56-3, EG-Nummer: 610-113-2, ECHA-InfoCard: 100.117.204, PubChem: 96141, ChemSpider: 86785, Wikidata: Q72455547.
- ↑ M. A. McCoy, D. Spicer, N. Wells, K. Hoogewijs, M. Fiedler, M. G. J. Baud: Biophysical Survey of Small-Molecule β-Catenin Inhibitors: A Cautionary Tale. In: Journal of Medicinal Chemistry. Band 65, Nr. 10, 26. Mai 2022, S. 7246–7261, doi:10.1021/acs.jmedchem.2c00228 (acs.org [PDF]).

