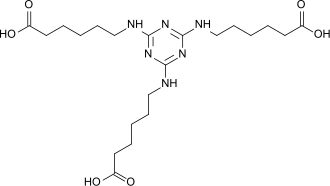
Triaminocapronsäuretriazin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Triaminocapronsäuretriazin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C21H36N6O6 | ||||||||||||||||||
| Kurzbeschreibung |
weißer bis schwach beiger kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 468,55 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,28 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
2,4,6-Tri(6-aminocapronsäure)-1,3,5-triazin (TACT) ist eine Tricarbonsäure, die durch Umsetzung von ε-Aminocapronsäure mit Cyanurchlorid entsteht und als Korrosionsschutzmittel in wässrigen Systemen und als trifunktioneller Baustein für verzweigte und sternförmige (Dendrimere) Polyamide Verwendung findet.
Darstellung[Bearbeiten | Quelltext bearbeiten]
Auf der Suche nach neuen Pflanzenschutzmitteln wurde im Jahr 1963 Triaminocapronsäuretriazin aus ε-Aminocapronsäure, Natronlauge und Cyanurchlorid erstmals dargestellt und beschrieben.[8]

Als preisgünstige Quelle für ε-Aminocapronsäure eignet sich ε-Caprolactam, das durch basische Hydrolyse mit Natriumhydroxid durch einstündiges Kochen unter Rückfluss in das gut wasserlösliche Natrium-6-aminohexanoat überführt wird.

Cyanurchlorid verfügt über drei Chloratome mit unterschiedlicher Reaktivität gegenüber Nukleophilen, was bei der Reaktionsführung ebenso berücksichtigt werden muss wie die Hydrolyseneigung von Cyanurchlorid in wässrigen Medien, insbesondere im alkalischen Milieu.
Daher werden die drei Reaktionskomponenten zunächst bei 0 bis 5 °C zwei Stunden reagieren lassen, dann drei Stunden bei 50 °C gehalten und anschließend noch 30 Minuten zum Sieden erhitzt. Das in 76%iger Ausbeute entstandene TACT wird durch Ansäuern ausgefällt. Dabei fallen ca. 20 % der so genannten Ammelidindihexansäure an, dem Disubstitutionsprodukt des Cyanurchlorids, bei dem das dritte Chloratom durch Hydrolyse im Alkalischen durch eine Hydroxygruppe ausgetauscht wurde.[9]
In anderen Patentschriften[3][5] wird in Wasser suspendiertes Cyanurchlorid vorgelegt und eine wässrig-alkalische Lösung des Natriumsalzes von 6-Aminohexansäure zugegeben.

Nach dem Verfahren der Degussa[9] wird eine alkalische ε-Aminocapronsäure-Lösung zur Cyanurchlorid-Suspension gegeben, die TACT bei 90 °C gefällt und noch heiß abfiltriert. Dabei beträgt die Produktausbeute 97,4 % und der Restgehalt an Ammelidindihexansäure nur noch 0,5 %. Die aminocapronsäurehaltige Mutterlauge wird in den Prozess zurückgeführt.
Die TACT-Synthese aus caprolactamhaltigem Abwasser ist als ebenfalls technisch gangbarer Weg im Detail beschrieben.[7]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
2,4,6-Tri(6-aminocapronsäure)-1,3,5-triazin ist weißer bis leicht beiger, geruchloser kristalliner Feststoff, der in Wasser bei neutralem pH-Wert kaum, in alkalischem pH sehr gut löslich ist. TACT besitzt ein geringes Wassergefährdungspotential.[10]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Triaminocapronsäuretriazin ist ein so genannter aschefreier und wenig schäumender Inhibitor für die Korrosion von Eisen und Eisen-Legierungen in wässrigen Systemen und wird meist als Kalium- bzw. Triethanolamin-Salz in Konzentrationen von 0,25 bis 1,1 % Wirkstoffgehalt eingesetzt.[10] Im Vergleich zu Triaminoalkansäuretriazinen mit kürzeren Alkylketten zeigt TACT die höchste antikorrosive Aktivität.[11] Die antikorrosive Wirkung kommt zustande durch Adsorption der TACT-Moleküle mit ihren Carboxylatfunktionen an die Metalloberfläche, wobei längere Alkylketten zu dickeren und dichteren Schutzschichten führen.
Triaminocapronsäuretriazin ist auch in hartem Wasser und bei Systemen mit mehreren Metallen ein hochwirksamer Korrosionsinhibitor. Durch Zusatz von TACT bzw. seiner Alkalimetall- oder Triethanolamin-Salze können wasserhaltige Kühl- und Gefrierschutzmittel, Hydraulikflüssigkeiten, Metallbearbeitungsflüssigkeiten und Kühlschmiermittel, wie Bohr- und Schneidemulsionen (engl. metal working fluids), sowie Kühlwasserkreisläufe und wässrige Anstrichmittel wirksam antikorrosiv ausgerüstet werden.
Triaminocapronsäuretriazin wurde auch als Comonomer, zusammen mit ε-Aminocapronsäure, mit dem Hauptmonomer ε-Caprolactam zur Herstellung verzweigter Polyamidfasern eingesetzt, die sich trotz fehlender Aminoendgruppen durch hohe Affinität zu sauren Farbstoffen auszeichnen.[12] Trotz der Verzweigungen in der Polymerkette lassen sich die Copolymeren gut verspinnen und die erhaltenen Fasern weisen die gleiche Schmelzviskosität auf wie das Ausgangspolymer, was auf die hohe thermische Stabilität des Copolyamids hinweist.
Mit TACT als Kern lassen sich auch dreiarmige Sternpolymere (engl. star-shaped polymers) mit hoher thermischer Stabilität durch Copolymerisation mit ε-Caprolactam herstellen,[5] die gleiche Eigenschaften wie ein entsprechendes lineares Copolyamid bereits nach wesentliche kürzeren Polymerisationszeiten zeigen.

Wegen des für Sternpolymere typischen geringeren hydrodynamischen Radius als lineare Polymere gleicher Zusammensetzung und Molmasse weisen die erhaltenen Copolyamide deutlich niedrigere Schmelz- und Lösungsviskositäten auf, womit – zumindest theoretisch – dünnwandigere Formen und Strukturen durch z. B. Spritzguss erzielbar sein sollten.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Safety Data Sheet, Irgacor® L 190, BASF SE (Die nachstehende Seite ist nicht mehr abrufbar. (Suche in Webarchiven.) Online).
- ↑ Safety Data Sheet, BELCOR 593 ( des vom 20. November 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., BWA Water Additives US LLC.
- ↑ a b Patent US4402907: Triazine carboxylic acids as corrosion inhibitors for aqueous systems. Angemeldet am 3. August 1981, veröffentlicht am 6. September 1983, Anmelder: Ciba-Geigy Corp., Erfinder: D.R. Clark.
- ↑ Patent CN101973949: 2,4,6-三(氨基己酸基)-1,3,5-三嗪的制备方法. Angemeldet am 17. November 2010, veröffentlicht am 16. Februar 2011, Anmelder: 天津师范大学, Erfinder: 刘巨艳, 刘海旺, 曹改娥, 王广辉, 王敬凤 (englischer Titel: Method for preparing 2,4,6-tri(amino caproyl)-1,3,5-triazine).
- ↑ a b c Patent US6060580: Star-shaped branched polyamide. Angemeldet am 3. November 1997, veröffentlicht am 9. Mai 2000, Anmelder: DSM N.V., Erfinder: A.J. Nijenhuis, M. Serné, E.M.M. de Brabander-van den Berg, R. Aberson.
- ↑ a b Eintrag zu Triazintriyltriiminotrihexansäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 5. November 2015. (JavaScript erforderlich)
- ↑ a b A. Lübbert, J. Hegmann: Verbesserung der Abwassersituation bei der Herstellung von Caprolactamdisulfid – Abschlussbericht zum Förderprogramm "Betriebliche Umwelttechnik" des Ministeriums für Umwelt, Naturschutz und Verkehr Baden Württemberg ( vom 20. November 2015 im Internet Archive). Rhein Chemie Rheinau GmbH, Januar 2009.
- ↑ Hans Nestler, Hans Fürst: Über die Darstellung von N(s-Triazinyl)-amino-säurederivaten. In: J. prakt. Chem. Band 22, Nr. 3–4, 1963, S. 173–185, doi:10.1002/prac.19630220306.
- ↑ a b Patent DE10208591: Verfahren zur Kristallisation von 6,6‘,6‘‘-Melamintrisalkansäuren. Angemeldet am 27. Februar 2002, veröffentlicht am 20. November 2003, Anmelder: Degussa AG, Erfinder: P. Werle, M. Trageser, H.-P. Krimmer.
- ↑ a b Metall-Chemie, Produktdatenblatt TC® 50.
- ↑ S.-H. Yoo, Y.-W. Kim, J. Shin, N.-K. Kim, J.-S. Kim: Effects of the Chain Length of Tris(carboxyalkylamino)triazine on Corrosion Inhibition Properties. In: Bull. Korean Chem. Soc. Band 36, 2015, S. 346–355, doi:10.1002/bkcs.10090.
- ↑ Patent US6074749: Acid dyeable fibre. Angemeldet am 4. Dezember 1998, veröffentlicht am 13. Juni 2000, Anmelder: DSM N.V., Erfinder: J.E.F. Arnauts, A.J. Nijenhuis, C. Versluis, R. Aberson.