Uroporphyrinogen III
Uroporphyrinogen III ist ein Tetrapyrrol, ein Vertreter der Uroporphyrinogene, das erste makrozyklische Zwischenprodukt in der Biosynthese von Hämoglobin, Chlorophyll, Vitamin B12 und Sirohäm. Wie andere Porphyrinogene ist auch Uroporphyrinogen III farblos.[1]
| Stoffwechselintermediat | |
|---|---|

| |
| Allgemeines | |
| Name |
Uroporphyrinogen III |
| Eigenschaften | |
| Summenformel | C40H44N4O16 |
| Molare Masse | 836,795 g·mol−1 |
| Identifikatoren | |
| CAS-Nummer | |
| PubChem | |
| Wikidata | |
Struktur
[Bearbeiten | Quelltext bearbeiten]Das zentrale Strukturelement des Uroporphyrinogen III ist ein Hexahydroporphin-Makrozyklus, wobei die Wasserstoffatome an den beiden äußersten Kohlenstoffatomen jedes Pyrrolrings durch eine Essigsäuregruppe (−CH2−COOH, „A“) und eine Propionsäuregruppe (−CH2−CH2−COOH, „P“) ersetzt sind. Die Gruppen sind asymmetrisch verknüpft: Um den Makrozyklus herum ist die Reihenfolge AP-AP-AP-PA.
Biosynthese und Metabolismus
[Bearbeiten | Quelltext bearbeiten]Im allgemeinen Porphyrinbiosyntheseweg wird Uroporphyrinogen III durch die Wirkung des Enzyms Uroporphyrinogen-III-Synthase aus dem linearen Tetrapyrrol Prä-Uroporphyrinogen (einem substituierten Hydroxymethylbilan) gewonnen.[2][3]
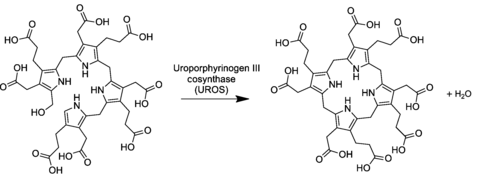
Die Umwandlung beinhaltet eine Umkehrung der letzten Pyrroleinheit (wodurch die Essigsäure- und Propionsäuregruppen vertauscht werden) und eine Kondensationsreaktion, die den Makrozyklus schließt, indem die OH-Gruppe am letzten Ring mittels eines Wasserstoffatoms des ersten Rings eliminiert wird.
Bei der Biosynthese von Häm- und Chlorophyll-Molekülen wird Uroporphyrinogen III durch das Enzym Uroporphyrinogen-Decarboxylase in Coproporphyrinogen III umgewandelt. Bei der Biosynthese der Sirohäm-Gruppen wird Uroporphyrinogen III durch zwei Methyltransferasen in Dihydrosirohydrochlorin umgewandelt, das anschließend zu Sirohydrochlorin oxidiert wird, einem Vorläufer der Sirohäm-Prosthetischen Gruppe.
Medizinische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Bei inaktiver oder nicht vorhandener Uroporphyrinogen-III-Synthase cyclisiert Hydroxymethylbilan spontan in das Strukturisomer Uroporphyrinogen I, das sich vom III-Isomer dadurch unterscheidet, dass die Essigsäure- („A“) und Propionsäure- („P“)-Gruppen in einer rotationssymmetrischen Reihenfolge um den Hydroporphin-Makrozyklus angeordnet sind, AP-AP-AP-AP. In diesem Fall entsteht im nächsten Schritt Coproporphyrinogen I, das sich im Körper akkumuliert und den pathologischen Zustand der kongenitalen erythropoetischen Porphyrie (Morbus Günther) verursacht[3].
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ J Dalton: Formation of the Macrocyclic Ring in Tetrapyrrole Biosynthesis. In: Nature. 223. Jahrgang, Nr. 5211, 1969, S. 1151–1153, doi:10.1038/2231151a0, PMID 5810686, bibcode:1969Natur.223.1151D.
- ↑ Paul R. Ortiz de Montellano: Wiley Encyclopedia of Chemical Biology. John Wiley & Sons, 2008, ISBN 978-0-470-04867-2, Hemes in Biology, S. 1–10, doi:10.1002/9780470048672.wecb221.
- ↑ a b S. Sassa and A. Kappas (2000): "Molecular aspects of the inherited porphyrias". Journal of Internal Medicine, volume 247, issue 2, pages 169-178. doi:10.1046/j.1365-2796.2000.00618.x