Dimethylsulfon
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Dimethylsulfon | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C2H6O2S | |||||||||||||||||||||
| Kurzbeschreibung | ||||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 94,13 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,17 g·cm−3[4] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−450,1 kJ/mol[5] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Dimethylsulfon ist der einfachste Vertreter aus der Stoffklasse der Sulfone, somit eine organische Schwefelverbindung. Es unterscheidet sich vom Lösungsmittel Dimethylsulfoxid durch ein zusätzlich gebundenes Sauerstoffatom am Schwefelatom.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Dimethylsulfon kommt in vielen tierischen und pflanzlichen Organismen vor und ist auch Bestandteil der menschlichen Ernährung. Vergleichsweise hohe Konzentrationen findet man in Kuhmilch (3,3 ppm) und Kaffee (1,6 ppm).
Darstellung
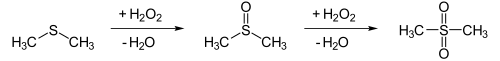
[Bearbeiten | Quelltext bearbeiten]Sulfone lassen sich generell durch Oxidation der entsprechenden Sulfide darstellen, Dimethylsulfon beispielsweise durch Oxidation von Dimethylsulfid mit Wasserstoffperoxid H2O2. Dabei entsteht als Zwischenprodukt Dimethylsulfoxid.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische und chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Reines Dimethylsulfon bildet farblose, geruchlose, wasserlösliche und leicht bitter schmeckende Kristalle. Der Schmelzpunkt wurde bei 109 °C mit einer Schmelzenthalpie von 18,28 kJ·mol−1 bestimmt.[6] Die molare Verdampfungsenthalpie beträgt am Siedepunkt 56,0 kJ·mol−1.[7] Die Verbindung ist brennbar, aber mit einem Flammpunkt von 143 °C schwer entzündbar.[2]
Ähnlich wie Dimethylsulfoxid ist Dimethylsulfon schwach CH-azid, sodass es durch starke Basen wie z. B. Butyllithium deprotoniert werden kann.
Pharmakologische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]In einem Tierversuch mit künstlich induzierten malignen Tumoren des Dickdarms und der Brust konnte ein verzögerter Krankheitsausbruch bei Gabe von Dimethylsulfon beobachtet werden. Forscher der koreanischen Universität Konkuk stellten im Jahr 2012 eine hemmende Wirkung von Dimethylsulfon auf menschliche Brustkrebszellen fest. Sowohl im in-vitro- als auch im in-vivo-Versuch beobachteten sie eine regulatorische Wirkung auf STAT3, STAT5b, IGF-1R, IGF-1 und VEGF, welche an Tumorentstehung, Tumorwachstum und Metastasierung beteiligt sind.[8]
Biologische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Ähnlich wie bei der Darstellung im Labor ist Dimethylsulfon auch im Organismus von Säugetieren das Produkt der Metabolisierung von Dimethylsulfoxid. Dieses wird in der Leber über das Cytochrom-P450-Enzymsystem zu Dimethylsulfon oxidiert und dann mit dem Harn ausgeschieden.
Verwendung als Nahrungsergänzungsmittel
[Bearbeiten | Quelltext bearbeiten]Dimethylsulfon wird, meist unter der Bezeichnung Methylsulfonylmethan (MSM), als Nahrungsergänzungsmittel für Menschen und Tiere, insbesondere Pferde, angeboten. Es soll einen Mangel an Schwefel im Organismus ausgleichen.
In der Ratgeberliteratur wird dem Stoff eine Vielzahl verschiedener Wirkungen zugesprochen, beispielsweise eine Förderung der Kollagenbildung, eine Stärkung des Immunsystems oder die Unterstützung der Darmfunktion.[9] Die Europäische Behörde für Lebensmittelsicherheit (EFSA) hat 2010 in einer Stellungnahme diese und andere behauptete gesundheitliche Wirkungen als wissenschaftlich nicht belegt gewertet, mit jenen im Zusammenhang mit MSM zugeschriebenen Wirkungen dürfe daher nicht geworben werden.[9]
Laut Magazin Öko-Test ergibt die zusätzliche Aufnahme von Schwefel in Form von Dimethylsulfon keinen Sinn, da in Deutschland keine Mangelernährung an Proteinen bestehe, welche die Hauptquelle für Schwefel in der Nahrung darstellen.[10] Wegen der proteinreichen Ernährung in westlichen Ländern ist ein „Schwefelmangel“ noch nicht beschrieben worden.[11] Die Verbraucherzentrale warnt und weist darauf hin, dass MSM weder Heilmittel, noch zugelassenes Medikament ist.[12] Darüber hinaus sind Nebenwirkungen bei der Langzeiteinnahme nicht bekannt.
Literatur
[Bearbeiten | Quelltext bearbeiten]- M. Butawan, R. L. Benjamin, R. J. Bloomer: Methylsulfonylmethane: Applications and Safety of a Novel Dietary Supplement. In: Nutrients. Band 9, Nr. 3, März 2017, doi:10.3390/nu9030290, PMID 28300758, PMC 5372953 (freier Volltext).
- Earl L. Mindell: The MSM Miracle : Enhance your health with organic sulfur. Keats Publishing, Connecticut, USA 1997, ISBN 0-87983-841-8.
- Stanley W. Jacob: The current Status of MSM in Medicine. In: Am Acad Med Prev. 1983.
- V. L. Richmond: Incorporation of MSM into Guinea Pig Serum Proteins. In: Life Science. 39, 1986, S. 263–268.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu DIMETHYL SULFONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 27. Juni 2020.
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 67-71-0 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. Januar 2024. (JavaScript erforderlich)
- ↑ a b c d Datenblatt Dimethylsulfon bei Merck, abgerufen am 19. Januar 2011.
- ↑ Eintrag zu Dimethylsulfon. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Mai 2014.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- ↑ E. S. Domalski, E. D. Hearing: Heat Capacities and Entropies of Organic Compounds in the Condensed Phase. Volume III. In: J. Phys. Chem. Ref. Data. 25, 1996, S. 1–525, doi:10.1063/1.555985.
- ↑ R. M. Stephenson, S. Malanowski: Handbook of the Thermodynamics of Organic Compounds. Springer 1987, ISBN 94-010-7923-4, doi:10.1007/978-94-009-3173-2.
- ↑ Eun Joung Lim et al.: Methylsulfonylmethane suppresses breast cancer growth by down-regulating STAT3 and STAT5b pathways. In: PloS One. Band 7, Nr. 4, 2012, S. e33361, doi:10.1371/journal.pone.0033361, PMID 22485142, PMC 3317666 (freier Volltext).
- ↑ a b Scientific Opinion on the substantiation of health claims related to methylsulphonylmethane (MSM) and contribution to normal collagen formation (ID 353, 388, 389, 394, 1695, 1741, 1874), maintenance of normal hair (ID 353, 1741, 1874), maintenance of normal nails (ID 1695, 1741, 1874), maintenance of normal acid-base balance (ID 387), “strengthens the immune system function” (ID 390), maintenance of normal bowel function (ID 391), contribution to the normal cysteine synthesis (ID 392) and “vitamin production needed for correct function of metabolism” (ID 393) pursuant to Article 13(1) of Regulation (EC) No 1924/2006. In: EFSA Journal. Band 8, Nr. 10, 19. Oktober 2010, S. 1746, doi:10.2903/j.efsa.2010.1746 (englisch).
- ↑ Mittel gegen Gelenkbeschwerden. Gelenkig geht anders. In: Öko-Test. Mai 2009.
- ↑ MSM – neues Wundermittel aus den USA. In: DAZ.online. 15. April 2001 (deutsche-apotheker-zeitung.de [abgerufen am 23. September 2018]).
- ↑ MSM - hilft die Schwefeltherapie bei Arthrose? | Verbraucherzentrale.de. 3. März 2020, abgerufen am 17. März 2020.