Benutzer:Orci/Namensreaktionen/K
Zur Navigation springen
Zur Suche springen
| Entdecker | Jahr | Reagenzien | Kurzbeschreibung | Zielmolekül(e) | Quelle |
|---|---|---|---|---|---|
| Kabachnik-Fields-Reaktion | |||||
| Martin Israilewitsch Kabachnik, Ellis K. Fields | 1952 | Aldehyde, Amine, Phosphonsäure | Mehrkomponentenreaktion | α-Aminophosphonate | [1][2] |

| |||||
| Kagan-Molander-Kupplung | |||||
| Henri Kagan, Gary Molander | 1980/84 | Alkylhalogenide, Ketone/Aldehyde, Samarium(II)-iodid | Kupplung | Alkohole | [3][4] |
| Kahne-Glycosidierung | |||||
| Daniel Kahne | 1989 | Glycosyl-Sulfoxide, Trifluormethansulfonsäureanhydrid, Nuleophil | Einführung der Triflylgruppe, Ersetzung der Gruppe durch das Nucleophil | stereoselektive O-, S- oder N-Glycoside | [5] |
| Kamlet-Reaktion | |||||
| siehe Henry-Reaktion | |||||
| Keck-Macrolactonisierung | |||||
| Gary E. Keck | 1985 | ω-Hydroxycarbonsäuren, Dicyclohexylcarbodiimid, 4-(Dimethylamino)pyridin, DMAP-HCl | Aktivierung, Steglich-Veresterung | Makrolactone | [6] |
| radikalische Keck-Allylierung | |||||
| Gary E. Keck | 1982 | Alkylhalogenide, Allyltributylstannan, AIBN | radikalische Substitution | Allylalkane | [7] |
| asymmetrische Keck-Allylierung | |||||
| Gary E. Keck | 1993 | Aldehyde, Allylstannane, BINOL, Titantetraisopropylat | Addition | enantioselektive Allylalkohole | [8] |
| Kemp-Eliminierung | |||||
| Daniel S. Kemp | 1973 | Benzisoxazole, Base | Ringöffnung | α-Nitrilophenole | [9] |

| |||||
| Kemp-Decarboxylierung | |||||
| Daniel S. Kemp | 1973 | Benzisoxazole mit Carboxygruppe am C3, Base | Ringöffnung mit Decarboxylierung | α-Nitrilophenole | [9] |
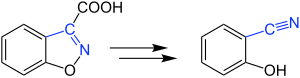
| |||||
| Kendall-Mattox-Reaktion | |||||
| Edward Calvin Kendall, Vernon R. Mattox | 1948 | α-Bromketone, Phenylhydrazin, 2-Oxopropanoat | α,β-ungesättigte Ketone | [10] | |

| |||||
| Kennedy-Oxidative Cyclisierung | |||||
| Robert M. Kennedy | 1992 | 5-Hdroxyalkene, Rhenium(VII)-oxid | stereoselektive Cyclisierung | trans-Tetrahydrofurane | [11] |
| Kiliani-Fischer-Synthese | |||||
| Heinrich Kiliani, Emil Fischer | 1885 | Monosaccharide, Blausäure, Wasser, Natriumamalgam | nucleophile Addition, Hydrolyse, Reduktion | verlängerte Monosaccaride | [12][13] |
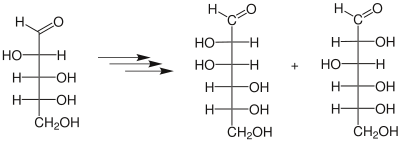
| |||||
| Kinugasa-Reaktion | |||||
| Kishner-Cyclopropansynthese (Kishner-Abbau) | |||||
| Nikolai Kischner | 1911 | α,β-ungesättigte Ketone, Hydrazin | Bildung eines Pyrazolines, Zersetzung | Cyclopropane | [14] |
| Knoevenagel-Reaktion | |||||
| Emil Knoevenagel | 1898 | Ketone/Aldehyde, CH-acide Verbindungen, Base | Deprotonierung, nucleophiler Angriff, Kondensation | Bildung einer C-C-Doppelbindung | [15] |

| |||||
| Knoevenagel-Diazotierung | |||||
| Emil Knoevenagel | 1890 | primäre Amine, Amylnitrit | Diazotierung | Diazoniumsalze | [16] |
| Knoop-Oesterlin-Aminosäuresynthese | |||||
| F. Knoop, Hubert Oesterlin | 1925 | α-Ketosäuren, Ammoniak, Wasserstoff/Palladium | katalytische Hydrierung | α-Aminosäuren | [17] |
| Knorr-Chinolinsynthese | |||||
| Ludwig Knorr | 1886 | Anilin, β-Ketoester, Säure | Cyclisierung unter Abspaltung von Wassser und Methanol | Chinoline | [18] |
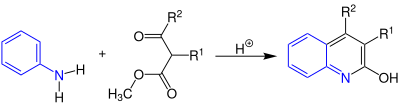
| |||||
| Knorr-Pyrazolsynthese | |||||
| Ludwig Knorr | 1883 | 1,3-Dicarbonnylverbindungen, Hydrazine | Kondensation | Pyrazole | [19] |

| |||||
| Knorr-Pyrrolsynthese | |||||
| Ludwig Knorr | 1885 | α-Aminoketone, β-Ketoester | Cyclisierung | Pyrrole | [20] |

| |||||
| Koch-Haaf-Carbonylierung (Koch-Reaktion) | |||||
| Herbert Koch, Wolfgang Haaf | 1958 | Alkene, Kohlenstoffmonoxid, Säure | Protonierung, nucleophiler Angriff des CO, Hydrolyse | Koch-Säuren | [21] |

| |||||
| Kochi-Reaktion | |||||
| Jay K. Kochi | 1965 | Carbonsäuren, Blei(IV)-acetat, Lithiumchlorid | oxidative Decarboxylierung | Halogenkohlenwasserstoffe | [22] |

| |||||
| Koenigs-Knorr-Methode | |||||
| Wilhelm Koenigs, Eduard Knorr | 1901 | Monosacccharid-halogenide, Silber(I)-carbonat, Methanol | Abspaltung des Halogenides, Nucleophile Substitution | Glycoside | [23] |

| |||||
| Kolbe-Elektrolyse | |||||
| Hermann Kolbe | 1848 | Carbonsäuren, elektrischer Strom | elektrolytische, radikalische Oxidation, CO2-Abspaltung, Dimerisierung | Alkane | [24] |

| |||||
| Kolbe-Nitrilsynthese | |||||
| Hermann Kolbe | |||||
| Kolbe-Schmitt-Reaktion | |||||
| Herrmann Kolbe, Rudolf Schmitt | 1860/84 | Phenole, Natrium/Kalium, Kohlenstoffdioxid | Deprotonierung, elektrophile Substitution | o- oder p-Hydroxybenzoesäure | [25][26] |

| |||||
| Kondrat’eva-Pyridinsynthese | |||||
| G. Y. Kondrat'eva | 1957 | Oxazol, Alkene | Diels-Alder-Reaktion | Pyridine | [27] |

| |||||
| Kornblum-Oxidation | |||||
| Nathan Kornblum | 1957 | Alkylhalogenide, Dimethylsulfoxid, Triethylamin | Oxidation | Aldehyde | [28] |

| |||||
| Kornblum-DeLaMare-Umlagerung | |||||
| Nathan Kornblum, Harold E. DeLaMare | 1951 | organische Peroxide, Base | Umlagerung | Ketone und Alkohole | [29] |
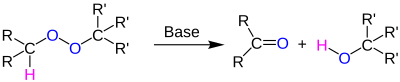
| |||||
| Kostanecki-Reaktion (Kostanecki-Robinson-Reaktion) | |||||
| Stanislaus von Kostanecki | 1901 | ortho-Hydroxyacetophenone, aliphatische Carbonsäureanhydride | Acylierung, Aldolkondensation | Cumarin, Chromone | [30] |

| |||||
| Kowalski-Ester-Homologierung | |||||
| Conrad J. Kowalski | 1985 | Carbonsäureester, Dibrommethyllithium, starke Base | Carbonsäureester mit um ein Glied verlängerter Kette | [31] | |

| |||||
| Krafft-Abbau | |||||
| Friedrich Krafft | 1879 | Erdalkalisalze von Carbonsäuren, entsprechende Acetate, Chrom(IV)-oxid | trockene Destillation zum Methylketon, Oxidation | verkürzte Carbonsäuren | [32] |
| Krapcho-Reaktion | |||||
| Andrew Paul Krapcho | 1967 | α-monosubstituierte oder α,α-disubstituierte Ester, Kaliumcyanid | Decarboxylierung | Ersetzen der Estergruppe durch H-Atom | [33] |
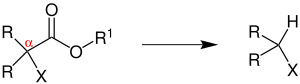
| |||||
| Kriewitz-Kondensation | |||||
| Oscar Kriewitz | 1899 | Olefine, Formaldehyd | Kondensation | ungesättigte primäre Alkohole | [34] |

| |||||
| Kröhnke-Pyridinsynthese | |||||
| Fritz Kröhnke | 1961 | Pyridin, α,β-ungesättigte Ketone | Synthese von Pyridinderivaten | Pyridinderivate | [35] |

| |||||
| Kutscherov-Reaktion | |||||
| Michail Kutscherow | 1881 | Alkine, Quecksilber(II)-sulfat, Säure | Hydratisierung | Aldehyde/Ketone | [36] |

| |||||
| Kuhn-Roth-Oxidation | |||||
| Richard Kuhn, Hubert Roth | 1933 | organische Moleküle, Chromsäure, Schwefelsäure | Oxidation zu Essigsäure | Bestimmung der Anzahl Methylgruppen in einem Molekül | [37] |
| Kuhn-Winterstein-Reaktion | |||||
| Richard Kuhn, Alfred Winterstein | 1928 | 1,2-Glycole, Diphosphotetraiodid | Reduktion | trans-Alkene | [38] |
| Kulinkovich-Reaktion | |||||
| Oleg Kulinkovich | 1989 | Carbonsäureester, Grignard-Verbindungen, Titan(IV)-alkoholat (Katalysator) | Transmetallierungen | Cyclopropanole | [39] |
| Kumada-Kupplung | |||||
| Makoto Kumada | 1972 | Alkenyl- oder Arylhalogenide, Grignard-Verbindungen, Nickel-Komplex (Katalysator) | Kupplung | Bildung einer C-C-Bindung | [40] |

| |||||
Quellen[Bearbeiten | Quelltext bearbeiten]
- ↑ Martin I. Kabachnik, T. Ya. Medved: Новый метод синтеза сс-аминофосфиновых кислот (A new method for the synthesis of α-amino phosphoric acids). In: Doklady Akademii Nauk SSSR. 83, 1952, S. 689.
- ↑ Ellis K. Fields: The Synthesis of Esters of Substituted Amino Phosphonic Acids. In: Journal of the American Chemical Society. 74, 1952, S. 1528, doi:10.1021/ja01126a054.
- ↑ P. Girard, J. L. Namy, H. B. Kagan: Divalent lanthanide derivatives in organic synthesis. 1. Mild preparation of samarium iodide and ytterbium iodide and their use as reducing or coupling agents. In: Journal of the American Chemical Society. 102, 1980, S. 2693, doi:10.1021/ja00528a029.
- ↑ Gary A. Molander, Jeffrey B. Etter: Lanthanides in organic synthesis. Synthesis of bicyclicalcohols. In: Tetrahedron Letters. 25, 1984, S. 3281, doi:10.1016/S0040-4039(01)81364-2.
- ↑ Daniel Kahne, Suzanne Walker, Yuan Cheng, Donna Van Engen: Glycosylation of unreactive substrates. In: Journal of the American Chemical Society. 111, 1989, S. 6881, doi:10.1021/ja00199a081.
- ↑ Eugene P. Boden, Gary E. Keck: Proton-transfer steps in Steglich esterification: a very practical new method for macrolactonization. In: The Journal of Organic Chemistry. 50, 1985, S. 2394, doi:10.1021/jo00213a044.
- ↑ Gary E. Keck, John B. Yates: Carbon-carbon bond formation via the reaction of trialkylallylstannanes with organic halides. In: Journal of the American Chemical Society. 104, 1982, S. 5829, doi:10.1021/ja00385a066.
- ↑ Gary E. Keck, Kenneth H. Tarbet, Leo S. Geraci: Catalytic asymmetric allylation of aldehydes. In: Journal of the American Chemical Society. 115, 1993, S. 8467, doi:10.1021/ja00071a074.
- ↑ a b D. S. Kemp, Martha L. Casey: Physical organic chemistry of benzisoxazoles. II. Linearity of the Broensted free energy relation for the base-catalyzed decomposition of benzisoxazoles. In: Journal of the American Chemical Society. 95, 1973, S. 6670, doi:10.1021/ja00801a024.
- ↑ Vernon R. Mattox, Edward C. Kendall: The preparation of 3-Keto-Δ4-steroids. In: Journal of the American Chemical Society. 70, 1948, S. 882, doi:10.1021/ja01182a532.
- ↑ Robert M. Kennedy, Suhan Tang: Directed oxidative cyclization of 5-hydroxyalkenes with rhenium oxide. In: Tetrahedron letters. 1992, Band 33, Nummer 26, S. 3729–3732 doi:10.1016/0040-4039(92)80010-H.
- ↑ Heinrich Kiliani: Ueber das Cyanhydrin der Lävulose. In: Berichte der deutschen chemischen Gesellschaft. 18, 1885, S. 3066, doi:10.1002/cber.188501802249.
- ↑ Emil Fischer: Reduction von Säuren der Zuckergruppe. In: Berichte der deutschen chemischen Gesellschaft. 22, 1889, S. 2204, doi:10.1002/cber.18890220291.
- ↑ N. M. Kishner, A. Zavadovskii: In: J. Russ. Phys. Chem. Soc. 43, 1911, S. 1132.
- ↑ E. Knoevenagel: Condensation von Malonsäure mit aromatischen Aldehyden durch Ammoniak und Amine. In: Berichte der deutschen chemischen Gesellschaft. 31, 1898, S. 2596, doi:10.1002/cber.18980310308.
- ↑ E. Knoevenagel: Zur Darstellung trockner Diazosalze. In: Berichte der Deutschen Chemischen Gesellschaft. 1890, Band 23, Nummer 2, S. 2994–2998 doi:10.1002/cber.189002302224.
- ↑ F. Knoop, Hubt. Oesterlin: Über die natürliche Synthese der Aminosäuren und ihre experimentelle Reproduktion. In: Hoppe-Seyler´s Zeitschrift für physiologische Chemie. 148, 1925, S. 294, doi:10.1515/bchm2.1925.148.3-6.294.
- ↑ Ludwig Knorr: Synthetische Versuche mit dem Acetessigester. In: Justus Liebig's Annalen der Chemie. 236, 1886, S. 69, doi:10.1002/jlac.18862360105.
- ↑ Ludwig Knorr: Einwirkung von Acetessigester auf Phenylhydrazin. In: Berichte der deutschen chemischen Gesellschaft. 16, 1883, S. 2597, doi:10.1002/cber.188301602194.
- ↑ Ludwig Knorr: Synthese von Pyrrolderivaten. In: Berichte der deutschen chemischen Gesellschaft. 17, 1884, S. 1635, doi:10.1002/cber.18840170220.
- ↑ Herbert Koch, Wolfgang Haaf: Über die Synthese verzweigter Carbonsäuren nach der Ameisensäure-Methode. In: Justus Liebigs Annalen der Chemie. 618, 1958, S. 251, doi:10.1002/jlac.19586180127.
- ↑ Jay K. Kochi: A New Method for Halodecarboxylation of Acids Using Lead(IV) Acetate. In: Journal of the American Chemical Society. 87, 1965, S. 2500, doi:10.1021/ja01089a041.
- ↑ Wilhelm Koenigs, Eduard Knorr: Ueber einige Derivate des Traubenzuckers und der Galactose. In: Berichte der deutschen chemischen Gesellschaft. 34, 1901, S. 957, doi:10.1002/cber.190103401162.
- ↑ Hermann Kolbe: Zersetzung der Valeriansäure durch den elektrischen Strom. In: Annalen der Chemie und Pharmacie. 64, 1848, S. 339, doi:10.1002/jlac.18480640346.
- ↑ H. Kolbe: Ueber Synthese der Salicylsäure. In: Annalen der Chemie und Pharmacie. 113, 1860, S. 125, doi:10.1002/jlac.18601130120.
- ↑ R. Schmitt: Beitrag zur Kenntniss der Kolbe'schen Salicylsäure Synthese. In: Journal für Praktische Chemie. 31, 1885, S. 397, doi:10.1002/prac.18850310130.
- ↑ G. Ya. Kondrat'eva: In: Khim. Nauk. Prom.. 1957, 2, S. 666.
- ↑ Nathan Kornblum, Jack W. Powers, George J. Anderson, Willard J. Jones, Harold O. Larson, Oscar Levand, William M. Weaver: A NEW AND SELECTIVE METHOD OF OXIDATION. In: Journal of the American Chemical Society. 79, 1957, S. 6562, doi:10.1021/ja01581a057.
- ↑ Nathan Kornblum, Harold E. DeLaMare: THE BASE CATALYZED DECOMPOSITION OF A DIALKYL PEROXIDE. In: Journal of the American Chemical Society. 1951, Band 73, Nummer 2, S. 880–881 doi:10.1021/ja01146a542.
- ↑ St. v. Kostanecki, A. Różycki: Ueber eine Bildungsweise von Chromonderivaten. In: Berichte der deutschen chemischen Gesellschaft. 34, 1901, S. 102, doi:10.1002/cber.19010340119.
- ↑ Conrad J. Kowalski, M. S. Haque, Kevin Fields: Ester homologation via .alpha.-bromo .alpha.-keto dianion rearrangement. In: Journal of the American Chemical Society. 1985, Band 107, Nummer 5, S. 1429–1430 doi:10.1021/ja00291a063.
- ↑ F. Krafft: Ueber die Laurinsäure und ihre Umwandlung in Undecylsäure. In: Berichte der deutschen chemischen Gesellschaft. 12, 1879, S. 1664, doi:10.1002/cber.187901202126.
- ↑ A.Paul Krapcho, Gary A. Glynn, Brian J. Grenon: The decarbethoxylation of geminal dicarbethoxy compounds. In: Tetrahedron Letters. 8, 1967, S. 215, doi:10.1016/S0040-4039(00)90519-7.
- ↑ O. Kriewitz: Ueber Addition von Formaldehyd an einige Terpene. In: Berichte der Deutschen Chemischen Gesellschaft. 1899, Band 32, Nummer 1, S. 57–60 doi:10.1002/cber.18990320111.
- ↑ Wilfried Zecher, Fritz Kröhnke: Eine neue Synthese substituierter Pyridine, I. Grundzüge der Synthese. In: Chemische Berichte. Band 94, Nr. 3, 1961, S. 690–697, doi:10.1002/cber.19610940317.
- ↑ M. Kutscheroff: Beobachtungen über Bromvinyl. In: Berichte der deutschen chemischen Gesellschaft. 14, 1881, S. 1532, doi:10.1002/cber.188101401319.
- ↑ Richard Kuhn, Hubert Roth: Mikro‐Bestimmung von Acetyl‐, Benzoyl‐ und C ‐Methylgruppen. In: Berichte der Deutschen Chemischen Gesellschaft. Abteilung B, Abhandlungen. 1933, Band 66, Nummer 9, S. 1274–1278 doi:10.1002/cber.19330660922.
- ↑ Richard Kuhn, Alfred Winterstein: Über konjugierte Doppelbindungen I. Synthese von Diphenyl-poly-enen. In: Helvetica Chimica Acta. 11, 1928, S. 87, doi:10.1002/hlca.19280110107.
- ↑ O. G. Kulinkovich, S. V. Sviridov, D. A. Vasilevskii, T. Pritytskaya. In: Zh. Org. Khim., 1989, 25, 2244.
- ↑ Kohei Tamao, Koji Sumitani, Makoto Kumada: Selective carbon-carbon bond formation by cross-coupling of Grignard reagents with organic halides. Catalysis by nickel-phosphine complexes. In: Journal of the American Chemical Society. 94, 1972, S. 4374, doi:10.1021/ja00767a075.