Benutzer:Orci/Namensreaktionen/S
Zur Navigation springen
Zur Suche springen
| Entdecker | Jahr | Reagenzien | Kurzbeschreibung | Zielmolekül(e) | Quelle |
|---|---|---|---|---|---|
| Sabatier-Senderens-Reduktion | |||||
| Paul Sabatier, Jean Baptiste Senderens | 1899 | ungesättigte organische Stoffe (Carbonylverbindungen, Alkene...), Wasserstoff, Nickel | Reduktion | gesättigte organische Stoffe (Alkohole, Kohlenwasserstoffe...) | [1] |
| Saegusa-Cyclisierung | |||||
| Takeo Saegusa | 1977 | ortho‐Alkylphenylisocyanide, Lithiumdiisopropylamid | Cyclisierung | Indole | [2] |
| Saegusa-Oxidation | |||||
| Takeo Saegusa | 1978 | Ketone/Aldehyde, Trimethylsilylchlorid, Base, Palladium(II)-acetat | Oxidation | (E)-konfigurierte α,β-ungesättigte Aldehyde/Ketone | [3] |

| |||||
| Sakurai-Reaktion | |||||
| siehe Hosomi-Sakurai-Reaktion | |||||
| Sandmeyer-Isatinsynthese | |||||
| Traugott Sandmeyer | 1919 | Chloral, Hydroxylamin, primäre Arylamine, Säure | Kondensation zum α-Isonitrosoacetanilid, Cyclisierung | Isatine | [4] |
| Sandmeyer-Reaktion | |||||
| Traugott Sandmeyer | 1884 | aromatische Amine, Natriumnitrit, Natriumchlorid/-bromid, Kupfer(I)-chlorid/-bromid | Diazotierung, radikalische Substitution | Chlor-/Bromaromaten | [5] |

| |||||
| Sarett-Oxidation | |||||
| Lewis Hastings Sarett | 1953 | primäre/sekundäre Alkohole, Chromtrioxid, Pyridin | Oxidation | Aldehyde/Ketone | [6] |

| |||||
| Schiemann-Reaktion | |||||
| siehe Balz-Schiemann-Reaktion | |||||
| Schlack-Kumpf-Reaktion (Johnson-Reaktion) | |||||
| P. Schlack, W. Kampf, Treat B. Johnson | 1911/26 | α-Aminosäuren, Thiocyanat, Essigsäureanhydrid | Sequenzierung von Peptiden | 2-Thiohydanthoin | [7][8] |
| Schlotterbeck-Reaktion | |||||
| siehe Büchner-Curtius-Schlotterbeck-Reaktion | |||||
| Schmidlin-Ketensynthese | |||||
| Julius Schmidlin | 1910 | Aceton, Hitze | Zersetzung in der Hitze | Keten | [9] |
| Schmidt-Glycosidierung | |||||
| Richard R. Schmidt | 1980 | Trichloroacetimidate, Monosaccharide, Lewis-Säure | Glycosidierung | Glycoside | [10] |
| Schmidt-Reaktion | |||||
| Karl-Friedrich Schmidt | 1924 | Carbonsäuren/Ketone, Schwefelsäure, Stickstoffwasserstoffsäure | Protonierung, nukleophile Addition, N2-Abspaltung, Hydrolyse | Amine/Amide | [11] |

| |||||
| Schmidt-Rutz-Reaktion | |||||
| Erich Schmidt, Gustav Rutz | 1928 | α-Nitroalkoholacetate, Natriumhydrogencarbonat | Eliminierung | Nitroalkene | [12] |
| Schmittel-Cyclisierung | |||||
| Michael Schmittel | 1995 | Hepta-1,2,4-trien-6-yne | intramolekulare C2-C6-Cyclisierung | Indene | [13] |
| Schöllkopf-Bislactim-Aminosäure-Synthese | |||||
| Ulrich Schöllkopf | 1979 | Glycin, Valin, Trimethyloxoniumtetrafluoroborat, Butyllithium, Alkyliodide, Säure | Bildung eines Bislactimethers, Methylierung, Deprotonierung, nucleophile Substitution, saure Hydrolyse | enantioselektive Aminosäuren | [14] |
| Schöllkopf-Oxazolsynthese | |||||
| Ulrich Schöllkopf | 1971 | Isocyanide, Acylierungsmittel (z.B. Carbonsäurechloride) | Kondensation | 4,5-disubstituierte Oxazole | [15] |

| |||||
| Scholl-Reaktion | |||||
| Roland Scholl | 1910 | Aromaten, Lewis-Säure | Kupplungsreaktion | C-C-Bindung zwischen Aromaten | [16] |

| |||||
| Schönberg-Umlagerung | |||||
| Alexander Schönberg | 1930 | Thioncarbonate | thermische Umlagerung | Thiolcarbonate | [17] |
| Schotten-Baumann-Methode | |||||
| Carl Schotten, Eugen Baumann | 1884/86 | Amine/Alkohole/Phenole, Carbonsäurechloride, Natronlauge | Bildung eines Halbacetals, Abspaltung von Chlorid und Proton | Carbonsäureester/-amide | [18][19] |

| |||||
| Screttas-Lithiierung | |||||
| Constantinos Screttas | 1978 | Alkylphenylsulfide, Lithiumnaphthalid | Reduktive Lithiierung | Organolithiumverbindungen | [20] |
| Screttas-Yus-Verfahren | |||||
| Constantinos Screttas, Miguel Yus | 1991 | Alkylchloride, Lithium, Di-tert-butylbiphenyl | Reduktive Lithiierung | Organolithiumverbindungen | [21] |
| Semmler-Wolff-Reaktion | |||||
| Friedrich Wilhelm Semmler, Ludwig Wolff | 1892/1902 | cyclische α,β-ungesättigte Ketooxime, Essigsäureanhydrid | Umlagerung | aromatische Amine | [22][23] |

| |||||
| Serini-Reaktion | |||||
| Arthur Serini | 1939 | steroidale 17-Hydroxy-20-essigsäureester, Zink | Steroid-Ketone | [24] | |

| |||||
| Seyferth-Gilbert-Kettenverlängerung | |||||
| Dietmar Seyferth, John C. Gilbert | 1970/1979 | Aldehyde/Ketone, Dimethyl-(diazomethyl)phosphonat, Kalium-tert-butanolat | Deprotonierung, nukleophiler Angriff, Ringschluss und Abspaltung von Dimethylphosphat, Abspaltung von Stickstoff zum Carben, Umlagerung | Alkine | [25][26] |

| |||||
| Shapiro-Reaktion | |||||
| Robert H. Shapiro | 1975 | Ketone, Arylsulfonhydrazide, Lithiumalkyle | Bamford-Stevens-Reaktion | Alkene | [27] |
| Sharpless-Dihydroxylierung | |||||
| Barry Sharpless | 1988 | Alkene, Osmium(VIII)-oxid, (DHQ)2PHAL oder (DHQD)2PHAL, NMO | asymmetrische katalytische Oxidation | cis-vicinale Diole | [28] |
| Sharpless-Aminohydroxylierung | |||||
| Barry Sharpless | 1996 | Alkene, Alkalimetallsalze von N-halogenierten Amiden/Sulfonamiden/Carbamaten, Osmium(VIII)-oxid, DHQ(D)-Verbindungen | asymmetrische katalytische Oxidation | vicinale Aminoalkohole | [29] |
| Sharpless-Epoxidierung | |||||
| Barry Sharpless | 1980 | Allylalkohole, Tetraisopropylorthotitanat, tert-Butylhydroperoxid, Weinsäurediethylester | asymmetrische Oxidation | ,3-Epoxyalkohole | [30] |
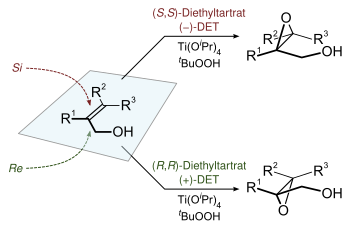
| |||||
| Sharpless-Olefinsynthese | |||||
| Barry Sharpless | 1973 | Alkohole, o-Nitrophenylselenocyanat, Tributylphosphin | Bildung eines Selenides, nukleophile Substitution, oxidative syn-Eliminierung | Alkene | [31] |
| Shechter-Kaplan-Oxidative-Nitrierung | |||||
| Harold Shechter, Ralph B. Kaplan | 1953 | Nitroalkane, Silbernitrat, Base | Oxidation | vicinale oder geminale Dinitroverbindungen | [32] |
| Shi-Epoxidierung | |||||
| Yian Shi | 1996 | Alkene, Peroxomonoschwefelsäure, Shi-Katalysator | katalytische asymmetrische Oxidation | enantioselektive Epoxide | [33] |
| Simonini-Reaktion | |||||
| Angelo Simonini | 1892 | Silbercarbonsäurensalze, Iod | Abspaltung von Silberiodid und CO2, nukleophile Substitution | Carbonsäureester | [34] |

| |||||
| Simmons-Smith-Reaktion | |||||
| Howard E. Simmons, Ronald D. Smith | 1958 | Alkene, Diiodmethan, Zink | Bildung eines Zinkcarbens, Addition an Doppelbindung | Cyclopropane | [35] |

| |||||
| Simonis-Chromon-Cyclisierung | |||||
| H. Simonis | 1913 | Phenole, β-Ketoester, Phosphorpentoxid | Pechmann-Kondensation | Chromone | [36] |
| Skattebøl-Umlagerung | |||||
| Lars Skattebøl | 1966 | geminale Dihalogencyclopropane, Lithiumalkyle | Umlagerung | Allene | [37] |

| |||||
| Skraup-Synthese | |||||
| Zdenko Hans Skraup | 1880 | Aniline, Glycerin, Schwefelsäure, Nitrobenzol | Bildung einer α,β-ungesättigten Carbonylverbindung, Addition, ringschließende Aldol-Kondensation, Dehydrierung | Chinoline | [38] |

| |||||
| Smiles-Umlagerung | |||||
| Samuel Smiles | 1931 | aromatische Sulfone/Sulfide/Ether | intramolekulare, nucleophile aromatische Substitution | [39] | |

| |||||
| Smith-Tietze-Kupplung | |||||
| Lutz Friedjan Tietze, Amos B. Smith | 1994 | silylierte 1,3-Dithiane, Epoxide, Alkyllithiumverbindungen, HMPA/DMPU | Deprotonierung, Kupplung, Brook-Umlagerung | 1,5-Diole | [40][41] |
| Snieckus-ortho-Metallierung | |||||
| Victor Snieckus | 1939 | Aromaten, Lithiumalkylverbindungen | elektrophile aromatische Substitution | ortho-metallierte Aromaten | [42][43] |
| Sommelet-Reaktion | |||||
| Marcel Sommelet | 1913 | Alkylhalogenide, Hexamethyltetramin, Säure | nukleophile Substitution zum Hexaminiumsalz, Deprotonierung mit Imin-Bildung, Hydrolyse | Aldehyde | [44] |

| |||||
| Sommelet-Hauser-Umlagerung | |||||
| Marcel Sommelet, Charles R. Hauser | 1937/51 | quartäre Benzylammoniumsalze, Natriumamid | Umlagerung | tertiäre Amine | [45][46] |

| |||||
| Sonn-Müller-Methode | |||||
| Adolf Sonn, Ernst Müller | 1919 | aromatische Anilide, Phosphor(V)-chlorid, Zinn(II)-chlorid, Salzsäure | Addition von Phosphor(V)-oxid, Eliminierung von Phosphoroxychlorid und Salzsäure, Reduktion, Protonierung, Hydrolyse | aromatische Aldehyde | [47] |

| |||||
| Sonogashira-Kupplung | |||||
| Kenkichi Sonogashira | 1975 | Arylhalogenide, endständige Alkine, Pd(0)-Komplex, Kupferhalogenid | Kupplung | Arylalkine | [48] |

| |||||
| Staudinger-Keten-Cycloaddition | |||||
| Hermann Staudinger | 1907 | Imine, Ketene | [2+2]-Cycloaddition | β-Lactam | [49] |

| |||||
| Staudinger-Reaktion | |||||
| Hermann Staudinger | 1919 | Azide, Triphenylphosphan | nukleophiler Angriff am Azid, Bildung eines Vierring, Abspaltung von Stickstoff, wässrige Aufarbeitung | primäre Amine | [50] |
| Stec-Reaktion | |||||
| Wojciech J. Stec | 1976 | Dialkyphosphoramidate, Carbonylverbindungen | Horner-Wadsworth-Emmons-Reaktion | P-chirale Biophosphate | [51] |
| Steglich-Umlagerung | |||||
| Wolfgang Steglich | 1968 | 5-Carboxyloxazole, 4-(Dimethylamino)pyridin | Umlagerung | 4- oder 2-Carboxylazlactone | [52] |
| Steglich-Veresterung | |||||
| Wolfgang Steglich | 1978 | Carbonsäuren, Alkohole, Dicyclohexylcarbodiimid, 4-Dimethylaminopyridin | Carbonsäureester | [53] | |
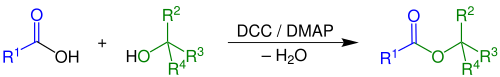
| |||||
| Stephens-Castro-Kupplung | |||||
| siehe Castro-Stephens-Kupplung | |||||
| Stephen-Reduktion | |||||
| Henry Stephen | 1925 | Nitrile, Zinn(II)-chlorid, Chlorwasserstoff | Reduktion | Aldehyde | [54] |
| Stetter-Reaktion | |||||
| Hermann Stetter | 1973 | Aldehyde, α,β-ungesättigtes Ketone, Cyanide | Addition des Cyanids, Michael-Reaktion, Eliminierung des Cyanids | 1,4-Diketone | [55] |

| |||||
| Stevens-Umlagerung | |||||
| Thomas Stevens Stevens | 1928 | Quartäre Ammoniumsalze oder Sulfoniumsalze, Base | [1,2]-Umlagerung | Amine | [56] |
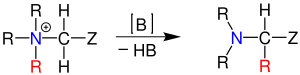
| |||||
| Stieglitz-Umlagerung | |||||
| Julius Stieglitz | 1913 | Triarylmethylamine, Säure | 1,2-Umlagerung | Triarylimine | [57] |
| Stille-Kupplung | |||||
| John Kenneth Stille | 1978 | Organische Zinnverbindungen, sp2-hybridisierte Alkylhalogenverbindungen, Pd(0)-Komplex | Kupplungsreaktion | Bildung einer C-C-Verbindung | [58] |
| Carbonylierende Stille-Kupplung | |||||
| John Kenneth Stille | 1984 | Organische Zinnverbindungen, sp2-hybridisierte Alkylhalogenverbindungen, Pd(0)-Komplex, Kohlenstoffmonoxid | Kupplungsreaktion | Bildung einer Carbonylverbindung | [59] |
| Stille-Kelly-Kupplung | |||||
| John Kenneth Stille, T. Ross Kelly | 1990 | sp2-hybridisierte Alkylhalogenverbindungen, Distannane, Pd(0)-Komplex, | intramolekulare Stille-Kupplung | Ringbildung | [60] |
| Still-Gennari-Phosphonatreaktion | |||||
| W. Clark Still, Cesare Gennari | 1983 | Aldehyde/Ketone, Trifluorethylphophonate, KHMDS/[18]-Krone-6 | Horner-Wadsworth-Emmons-Reaktion | (Z)-Alkene | [61] |
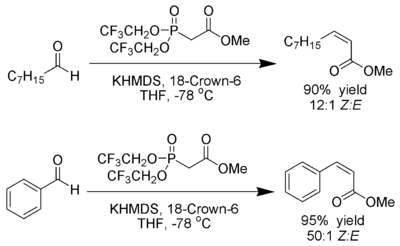
| |||||
| Stobbe-Kondensation | |||||
| Hans Stobbe | 1893 | Bernsteinsäurediester, Aldehyde/Ketone, Base | Aldol-Kondensation | α,β-ungesättigte Ester | [62] |

| |||||
| Stollé-Becker-Synthese | |||||
| Robert Stollé, W. Becker | 1924 | N-Benzylidenaminoisatine, Base | 3-Phenyl-4-carboxylcinnoline | [63] | |
| Stollé-Synthese | |||||
| Robert Stollé | 1913 | Arylamine, α-halogenierte Carbonsäurechloride/Oxalylchlorid, Aluminiumtrichlorid | Bildung eines Arylamides, Cyclisierung | Indol-Derivate | [64] |
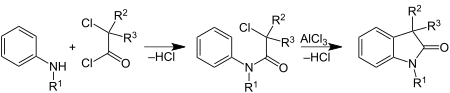
| |||||
| Stork-Reaktion | |||||
| Gilbert Stork | 1954 | Carbonylverbindungen, Pyrrolidin, Alkylhalogenverbindungen | Bildung eines Enamins, Michael-Addition, Hydrolyse | α-substituierte Carbonylverbindungen | [65] |
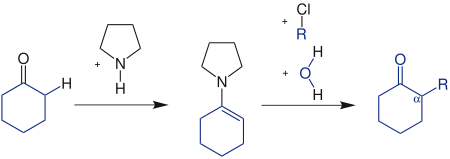
| |||||
| Strecker-Abbau | |||||
| Adolph Strecker | 1862 | Aminosäuren, Oxidationsmittel (z.B. Alloxan) | Oxidation, Hydrolyse | Aldehyde/Ketone | [66] |

| |||||
| Strecker-Sulfit-Alkylierung (Strecker-Reaktion) | |||||
| Adolph Strecker | 1868 | Alkylhalogenide, Alkalisulfite, Iodide | Alkylsulfonate | [67] | |
| Strecker-Synthese | |||||
| Adolph Strecker | 1850 | Aldehyde, Ammoniak, Cyanwasserstoff, Säure | Mannich-Reaktion, Hydrolyse | Aminosäuren | [68] |

| |||||
| Stevens-Castro-Kupplung | |||||
| siehe Castro-Stevens-Kupplung | |||||
| Suarez-Spaltung (Suarez-Reaktion) | |||||
| Ernesto Suárez | 1984 | Hydroxyhaltige Verbindungen, hypervalente Iodverbindungen | photoinduzierte Spaltung | auerstoffzentrierte Radikale | [69] |
| Sugasawa-Indolsynthese | |||||
| Tsutomu Sugasawa | 1979 | Aniline, Chloracetonitril, Bortrichlorid, Natriumborhydrid | Acylierung, Reduktion, Cyclisierung | Indole | [70] |

| |||||
| Sugasawa-Reaktion | |||||
| Tsutomu Sugasawa | 1978 | Aniline, Nitrile, Bortrichlorid, Lewis-Säure | elektrophile aromatische Substitution | ortho-Acylaniline | [71] |
| Sundberg-Indolsynthese | |||||
| Richard J. Sundberg | 1972 | o-Azidostyrene | Thermolyse | Indole | [72] |
| Suzuki-Kupplung | |||||
| Akira Suzuki | 1979 | Organoboranverbindungen, Halogenaromaten/-vinylverbindungen, Pd(0)-Phosphankomplex, Base | Kupplungsreaktion | Bildung einer C-C-Bindung | [73] |
| Swarts-Reaktion | |||||
| Frédéric Swarts | 1892 | organische Polychloride, Antimon(III)-fluorid, Antimon(V)-chlorid/Chlor | Oxidation zu Antimondichloridtrifluorid, Halogenaustausch | Fluor- und Chlorfluorkohlenwasserstoffe | [74] |

| |||||
| Swern-Oxidation | |||||
| Daniel Swern | 1978 | Alkohole, Dimethylsulfoxid, Oxalylchlorid, Triethylamin | Oxidation | Aldehyde/Ketone | [75] |
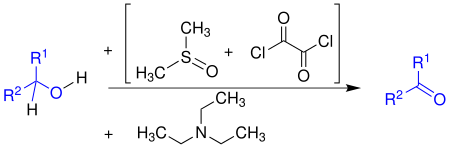
| |||||
Quellen[Bearbeiten | Quelltext bearbeiten]
- ↑ Paul Sabatier, Jean Baptiste Senderens: Hydrogénation de l'acétylène en présence du nickel. In: Comptes Rendus. 128, 1899, S. 1173 (Digitalisat auf Gallica ).
- ↑ Yoshihiko Ito, Kazuhiro Kobayashi, Takeo Sàegusa: An efficient synthesis of indole. In: Journal of the American Chemical Society. 1977, Band 99, Nummer 10, S. 3532–3534 doi:10.1021/ja00452a073.
- ↑ Yoshihiko Ito, Toshikazu Hirao, Takeo Saegusa: Synthesis of .alpha.,.beta.-unsaturated carbonyl compounds by palladium(II)-catalyzed dehydrosilylation of silyl enol ethers. In: The Journal of Organic Chemistry. 43, 1978, S. 1011, doi:10.1021/jo00399a052.
- ↑ Traugott Sandmeyer: Über Isonitrosoacetanilide und deren Kondensation zu Isatinen. In: Helvetica chimica acta. 1919, Band 2, Nummer 1, S. 234–242 doi:10.1002/hlca.19190020125.
- ↑ Traugott Sandmeyer: Ueber die Ersetzung der Amidgruppe durch Chlor in den aromatischen Substanzen. In: Berichte der deutschen chemischen Gesellschaft. 17, 1884, S. 1633, doi:10.1002/cber.18840170219.
- ↑ G. I. Poos, G. E. Arth, R. E. Beyler, L. H. Sarett: Approaches to the Total Synthesis of Adrenal Steroids. V. 4b-Methyl-7- ethylenedioxy-1,2,3,4,4aα,4b,5,6,7,8,10,10a β-dodecahydrophenanthrene-4 β-ol-1-one and Related Tricyclic Derivatives. In: Journal of the American Chemical Society. 75, 1953, S. 422, doi:10.1021/ja01098a049.
- ↑ Treat B. Johnson, Ben H. Nicolet: HYDANTOINS: THE SYNTHESIS OF 2-THIOHYDANTOIN. [SEVENTH PAPER.]. In: Journal of the American Chemical Society. 1911, Band 33, Nummer 12, S. 1973–1978 doi:10.1021/ja02225a014.
- ↑ P. Schlack, W. Kampf: Über eine neue Methode zur Ermittlung der Konstitution von Peptiden. In: Hoppe-Seyler's Zeitschrift für Physiologische Chemie. 1926, Band 154, Nummer 1-3, S. 125–172 doi:10.1515/bchm2.1926.154.1-3.125.
- ↑ Julius Schmidlin, Maximilian Bergman: Darstellung des Ketens aus Aceton. In: Berichte der Deutschen Chemischen Gesellschaft. 1910, Band 43, Nummer 3, S. 2821–2823 doi:10.1002/cber.19100430340.
- ↑ Richard R. Schmidt, Josef Michel: Einfache Synthese von α-und β-O-Glykosylimidaten; Herstellung von Glykosiden und Disacchariden. In: Angewandte Chemie. 1980, Band 92, Nummer 9, S. 763–764 doi:10.1002/ange.19800920933.
- ↑ Karl Friedrich Schmidt: Über den Imin-Rest. In: Berichte der deutschen chemischen Gesellschaft. 57, 1924, S. 704, doi:10.1002/cber.19240570423.
- ↑ Erich Schmidt, Gustav Rutz: Methode zur Darstellung von Nitro‐ und Chlor‐nitro‐olefinen. In: Berichte der Deutschen Chemischen Gesellschaft. Abteilung B, Abhandlungen. 1928, Band 61, Nummer 9, S. 2142–2148 doi:10.1002/cber.19280610915.
- ↑ Michael Schmittel, Marc Strittmatter, Susanne Kiau: Switching from the Myers reaction to a new thermal cyclization mode in enyne-allenes. In: Tetrahedron letters. 1995, Band 36, Nummer 28, S. 4975–4978 doi:10.1016/0040-4039(95)00937-8.
- ↑ Ulrich Schöllkopf, Wolfgang Hartwig, Ulrich Groth: Enantioselektive Synthese von α‐Methyl‐α‐amino‐carbonsäuren durch Alkylierung des Lactimethers von cyclo‐(L‐Ala‐L‐Ala). In: Angewandte Chemie. 1979, Band 91, Nummer 11, S. 922–923 doi:10.1002/ange.19790911110.
- ↑ Ulrich Schöllkopf, Rolf Schröder: 2‐Unsubstituierte Oxazole aus α‐metallierten Isocyaniden und Acylierungsmitteln. In: Angewandte Chemie. 1971, Band 83, Nummer 10, S. 358–359 doi:10.1002/ange.19710831007.
- ↑ R. Scholl, Chr. Seer, R. Weitzenböck: Perylen, ein hoch kondensierter aromatischer Kohlenwasserstoff C20H12. In: Berichte der deutschen chemischen Gesellschaft. 43, 1910, S. 2202, doi:10.1002/cber.191004302175.
- ↑ Alexander Schönberg, L. Vargha: Über die (thermische) Umlagerung von Thion‐Kohlensäure‐estern in Thiol‐kohlensäure‐ester. (16. Mitteil.) über organische Schwefelverbindungen.). In: Berichte der Deutschen Chemischen Gesellschaft. Abteilung B, Abhandlungen. 1930, Band 63, Nummer 1, S. 178–180 doi:10.1002/cber.19300630125.
- ↑ C. Schotten: Ueber die Oxydation des Piperidins. In: Berichte der deutschen chemischen Gesellschaft. 17, 1884, S. 2544, doi:10.1002/cber.188401702178.
- ↑ E. Baumann: Ueber eine einfache Methode der Darstellung von Benzoësäureäthern. In: Berichte der deutschen chemischen Gesellschaft. 19, 1886, S. 3218, doi:10.1002/cber.188601902348.
- ↑ Constantinos G. Screttas, Maria Micha‐Screttas: Hydrolithiation of .alpha.-olefins by a regiospecific two-step process. Transformation of alkyl phenyl sulfides to alkyllithium reagents. In: Journal of organic chemistry. 1978, Band 43, Nummer 6, S. 1064–1071 doi:10.1021/jo00400a008.
- ↑ Miguel Yus, Diego J. Ramón: Arene-catalysed lithiation reactions with lithium at low temperature. In: Journal of the Chemical Society. Chemical communications. 1991, Nummer 6, S. 398–400 doi:10.1039/C39910000398.
- ↑ Fr. W. Semmler: Ueber die Umwandlung des Tanacetoxims in das Cymidin. In: Berichte der deutschen chemischen Gesellschaft. 25, 1892, S. 3352, doi:10.1002/cber.189202502200.
- ↑ Ludwig Wolff: Condensationsproducte der Tetronsäure. In: Justus Liebig's Annalen der Chemie. 322, 1902, S. 351, doi:10.1002/jlac.19023220304.
- ↑ Arthur Serini, Willy Logemann, Walter Hildebrand: Über die Darstellung von Inhaltsstoffen der Nebennierenrinde. In: Berichte der deutschen chemischen Gesellschaft. 72, 1939, S. 391, doi:10.1002/cber.19390720228.
- ↑ Dietmar Seyferth, Robert S. Marmor: Dimethyl diazomethylphosphonate: its preparation and reactions. In: Tetrahedron Letters. 11, 1970, S. 2493, doi:10.1016/S0040-4039(01)98264-4.
- ↑ J. C. Gilbert, U. Weerasooriya: Elaboration of aldehydes and ketones to alkynes: improved methodology. In: The Journal of Organic Chemistry. 44, 1979, S. 4997, doi:10.1021/jo00394a063.
- ↑ Robert H. Shapiro, M.F. Lipton, K.J. Kolonko, R.L. Buswell, L.A. Capuano: Tosylhydrazones and alkyllithium reagents: More on the regiospecificity of the reaction and the trapping of three intermediates. In: Tetrahedron Letters. 16, 1975, S. 1811, doi:10.1016/S0040-4039(00)75263-4.
- ↑ Eric N. Jacobsen, Istvan Marko, William S. Mungall, Georg Schroeder, K. Barry Sharpless: Asymmetric dihydroxylation via ligand-accelerated catalysis. In: Journal of the American Chemical Society. 110, 1988, S. 1968, doi:10.1021/ja00214a053.
- ↑ Guigen Li, Han-Ting Chang, K. Barry Sharpless: Katalytische asymmetrische Aminohydroxylierung (AA) von Olefinen. In: Angewandte Chemie. 108, 1996, S. 449, doi:10.1002/ange.19961080409.
- ↑ Tsutomu Katsuki, K. Barry Sharpless: The first practical method for asymmetric epoxidation. In: Journal of the American Chemical Society. 102, 1980, S. 5974, doi:10.1021/ja00538a077.
- ↑ K.B. Sharpless, M.W. Young, R.F. Lauer: Reactions of selenoxides: Thermal -elimination and H218O exchange. In: Tetrahedron Letters. 14, 1973, S. 1979, doi:10.1016/S0040-4039(01)96098-8.
- ↑ Harold Shechter, Ralph B. Kaplan: The Action of Oxidizing Agents on Salts of Nitroalkanes. I. Oxidative Dimerization1,2,3. In: Journal of the American Chemical Society. 1953, Band 75, Nummer 16, S. 3980–3983 doi:10.1021/ja01112a031.
- ↑ Yong Tu, Zhi-Xian Wang, Yian Shi: An Efficient Asymmetric Epoxidation Method for trans-Olefins Mediated by a Fructose-Derived Ketone. In: Journal of the American Chemical Society. 118, 1996, S. 9806, doi:10.1021/ja962345g.
- ↑ Angelo Simonini: Über den Abbau der fetten Säuren zu kohlenstoffärmeren Alkoholen. In: Monatshefte für Chemie. 13, 1892, S. 320, doi:10.1007/BF01523646.
- ↑ Howard E. Simmons, Ronald D. Smith: A new synthesis of cyclopropanes from olefins. In: Journal of the American Chemical Society. 80, 1958, S. 5323, doi:10.1021/ja01552a080.
- ↑ Ernst Petschek, H. Simonis: Eine neue Chromon-Synthese. In: Berichte der deutschen chemischen Gesellschaft. 46, 1913, S. 2014, doi:10.1002/cber.191304602117.
- ↑ Lars Skattebøl: Chemistry of gem-Dihalocyclopropanes. V. Formation of Tricyclo[4.1.0.0]heptane and Derivatives. In: The Journal of Organic Chemistry. 31, 1966, S. 2789, doi:10.1021/jo01347a014.
- ↑ Zd. H. Skraup: Eine Synthese des Chinolins. In: Monatshefte für Chemie. 1, 1880, S. 316, doi:10.1007/BF01517073.
- ↑ Arthur A. Levy, Harry C. Rains, Samuel Smiles: CCCCLII.—The rearrangement of hydroxy-sulphones. Part I. In: J. Chem. Soc.. 0, 1931, S. 3264, doi:10.1039/JR9310003264.
- ↑ L. F. Tietze, H. Geissler, J. A. Gewert, U. Jakobi: Tandem-Bisalkylation of 2-Trialkylsilyl-1,3-dithiane: A New Sequential Transformation for the Synthesis of C2-Symmetrical Enantiopure 1,5-Diols and β,β′-Dihydroxyketones as well as of Enantiopure 1,3,5-Triols. In: Synlett. 1994, 1994, S. 511, doi:10.1055/s-1994-22908.
- ↑ Amos B. Smith, Armen M. Boldi: Multicomponent Linchpin Couplings of Silyl Dithianes via Solvent-Controlled Brook Rearrangement. In: Journal of the American Chemical Society. 119, 1997, S. 6925, doi:10.1021/ja970371o.
- ↑ Henry. Gilman, Robert L. Bebb: Relative Reactivities of Organometallic Compounds. XX.* Metalation. In: Journal of the American Chemical Society. 61, 1939, S. 109, doi:10.1021/ja01870a037.
- ↑ Victor A. Snieckus: Heterocycles via ortho-Lithiated Benzamides. In: Heterocycles. 14, 1980, S. 1649, doi:10.3987/R-1980-10-1649.
- ↑ Marcel Sommelet: Sur un mode de décomposition des halogénoalkoylates d'hexaméthylène-tétramine. In: Comptes rendus. 157, 1913, S. 852 (Digitalisat auf Gallica)
- ↑ Marcel Sommelet: Sur un mode particulier de réarrangement intramoléculaire. In: Comptes rendus. 205, 1937, S. 56 (Digitalisat auf Gallica)
- ↑ Simon W. Kantor, Charles R. Hauser: Rearrangements of Benzyltrimethylammonium Ion and Related Quaternary Ammonium Ions by Sodium Amide Involving Migration into the Ring. In: Journal of the American Chemical Society. 73, 1951, S. 4122, doi:10.1021/ja01153a022.
- ↑ Adolf Sonn, Ernst Müller: Über eine neue Methode zur Umwandlung von Carbonsäuren in Aldehyde. In: Berichte der deutschen chemischen Gesellschaft. 52, 1919, S. 1927, doi:10.1002/cber.19190521002.
- ↑ Kenkichi Sonogashira, Yasuo Tohda, Nobue Hagihara: A convenient synthesis of acetylenes: catalytic substitutions of acetylenic hydrogen with bromoalkenes, iodoarenes and bromopyridines. In: Tetrahedron Letters. 16, 1975, S. 4467, doi:10.1016/S0040-4039(00)91094-3.
- ↑ Hermann Staudinger: Zur Kenntniss der Ketene. Diphenylketen. In: Justus Liebig's Annalen der Chemie. 356, 1907, S. 51, doi:10.1002/jlac.19073560106.
- ↑ H. Staudinger, Jules Meyer: Über neue organische Phosphorverbindungen III. Phosphinmethylenderivate und Phosphinimine. In: Helvetica Chimica Acta. 2, 1919, S. 635, doi:10.1002/hlca.19190020164.
- ↑ Wojciech Zieliński, Zbigniew J. Leśnikowski, Wojciech J. Stec: New approach to the synthesis of nucleoside phosphorothioates. In: Journal of the Chemical Society. Chemical communications. 1976, Nummer 19, S. 772–773 doi:10.1039/C39760000772.
- ↑ Wolfgang Steglich, Gerhard Höfle: 5-Acyloxyoxazole und ihre Umlagerung in 4-Acyloxazol-5-one. In: Angewandte Chemie. 1968, Band 80, Nummer 2, S. 78 doi:10.1002/ange.19680800204.
- ↑ Bernhard Neises, Wolfgang Steglich: Einfaches Verfahren zur Veresterung von Carbonsäuren. In: Angewandte Chemie. 90, 1978, S. 556, doi:10.1002/ange.19780900718.
- ↑ Henry Stephen: CCLII.—A new synthesis of aldehydes. In: J. Chem. Soc., Trans.. 127, 1925, S. 1874, doi:10.1039/CT9252701874.
- ↑ Hermann Stetter, Manfred Schreckenberg: Eine neue Methode zur Addition von Aldehyden an aktivierte Doppelbindungen. In: Angewandte Chemie. 85, 1973, S. 89, doi:10.1002/ange.19730850208.
- ↑ Thomas Stevens Stevens, Elton Marshall Creighton, Alexander Brown Gordon, Malcolm MacNicol: CCCCXXIII.—Degradation of quaternary ammonium salts. Part I. In: J. Chem. Soc.. 0, 1928, S. 3193, doi:10.1039/JR9280003193.
- ↑ Julius Stieglitz, Paul Nicholas Leech: The molecular rearrangement of triarylmethyl-hydroxylamine and the "Beckmann" rearrangement of ketoximes. In: Journal of the American Chemical Society. 36, 1914, S. 272, doi:10.1021/ja02179a008.
- ↑ D. Milstein, J. K. Stille: A general, selective, and facile method for ketone synthesis from acid chlorides and organotin compounds catalyzed by palladium. In: Journal of the American Chemical Society. 100, 1978, S. 3636, doi:10.1021/ja00479a077.
- ↑ J. H. Merrifield, J. P. Godschalx, J. K. Stille: Synthesis of unsymmetrical diallyl ketones: the palladium-catalyzed coupling of allyl halides with allyltin reagents in the presence of carbon monoxide. In: Organometallics. 3, 1984, S. 1108, doi:10.1021/om00085a025.
- ↑ T. Ross Kelly, Qun Li, Vidya Bhushan: Intramolecular biaryl coupling: Asymmetric synthesis of the chiral b-ring diol unit of pradimicinone. In: Tetrahedron Letters. 31, 1990, S. 161, doi:10.1016/S0040-4039(00)94359-4.
- ↑ W.Clark Still, Cesare Gennari: Direct synthesis of Z-unsaturated esters. A useful modification of the horner-emmons olefination.. In: Tetrahedron Letters. 24, 1983, S. 4405, doi:10.1016/S0040-4039(00)85909-2.
- ↑ Hans Stobbe: Eine neue Synthese der Teraconsäure. In: Berichte der deutschen chemischen Gesellschaft. 26, 1893, S. 2312, doi:10.1002/CBER.18930260306.
- ↑ R. Stollé, W. Becker: Über N‐Amino‐isatin. In: Berichte der Deutschen Chemischen Gesellschaft. Abteilung B, Abhandlungen. 1924, Band 57, Nummer 7, S. 1123–1124 doi:10.1002/cber.19240570712.
- ↑ R. Stollé: Über eine neue Methode zur DarstellungN-substituierter Isatine. (Vorläufige Mitteilung). In: Berichte der deutschen chemischen Gesellschaft. 46, 1913, S. 3915, doi:10.1002/cber.191304603186.
- ↑ Gilbert Stork, Ross Terrell, Jacob Szmuszkovicz: A new synthesis of 2-alkyl and 2-acyl ketones. In: Journal of the American Chemical Society. 76, 1954, S. 2029, doi:10.1021/ja01636a103.
- ↑ Adolph Strecker: Notiz über eine eigenthümliche Oxydation durch Alloxan. In: Annalen der Chemie und Pharmacie. 123, 1862, S. 363, doi:10.1002/jlac.18621230312.
- ↑ Aldolph Strecker: Ueber eine neue Bildungsweise und die Constitution der Sulfosäuren. In: Annalen der Chemie und Pharmacie. 148, 1868, S. 90, doi:10.1002/jlac.18681480108.
- ↑ Adolph Strecker: Ueber die künstliche Bildung der Milchsäure und einen neuen, dem Glycocoll homologen Körper;. In: Annalen der Chemie und Pharmacie. 75, 1850, S. 27, doi:10.1002/jlac.18500750103.
- ↑ José I. Concepción, Cosme G. Francisco, Rosendo Hernández, José A. Salazar, Ernesto Suárez: Intramolecular hydrogen abstraction. Iodosobenzene diacetate, an efficient and convenient reagent for alkoxy radical generation. In: Tetrahedron Letters. 25, 1984, S. 1953, doi:10.1016/S0040-4039(01)90085-1.
- ↑ Tsutomu Sugasawa, Makoto Adachi, Kazuyuki Sasakura, Akiko Kitagawa: Aminohaloborane in organic synthesis. 2. Simple synthesis of indoles and 1-acyl-3-indolinones using specific ortho .alpha.-chloroacetylation of anilines. In: Journal of organic chemistry. 1979, Band 44, Nummer 4, S. 578–586 doi:10.1021/jo01318a021.
- ↑ Tsutomu Sugasawa, Tatsuo Toyoda, Makoto Adachi, Kazuyuki Sasakura: Aminohaloborane in organic synthesis. 1. Specific ortho substitution reaction of anilines. In: Journal of the American Chemical Society. 100, 1978, S. 4842, doi:10.1021/ja00483a034.
- ↑ Richard J. Sundberg, Henry F. Russell, Woodvin V. Ligon, Long-Su Lin: o-Styrylnitrene route to 2-substituted indoles. Pyrolysis of o-azidostyrenes. In: Journal of organic chemistry. 1972, Band 37, Nummer 5, S. 719–724 doi:10.1021/jo00970a010.
- ↑ Norio Miyaura, Akira Suzuki: Stereoselective synthesis of arylated (E)-alkenes by the reaction of alk-1-enylboranes with aryl halides in the presence of palladium catalyst. In: Journal of the Chemical Society, Chemical Communications. 1979, S. 866, doi:10.1039/C39790000866.
- ↑ Frédéric Swarts: Étude sur la fluoroforme. In: Bulletins de l'Académie royale Belgique. 24, 3, 1892, S. 474 (online auf Biodiversitylibrary.org).
- ↑ Kanji Omura, Daniel Swern: Oxidation of alcohols by “activated” dimethyl sulfoxide. a preparative, steric and mechanistic study. In: Tetrahedron. 34, 1978, S. 1651, doi:10.1016/0040-4020(78)80197-5.
